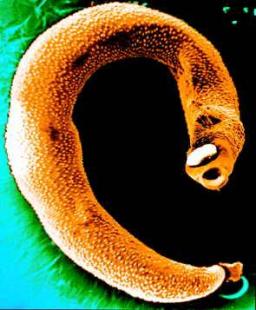
Trois principales espèces de schistosomes - S. mansoni, S. japonicum et S. haematobium - peuvent infecter l'homme et provoquer une bilharziose, intestinale (pour les deux premiers) ou urinaire [on connaît aussi S. intercalatum, responsable de bilharziose rectale en Afrique]. L'infection survient lorsque les larves (cercaires) nageant dans l'eau pénètrent la peau d'un individu. Après plusieurs jours, les vers mâles et femelles développés s'accouplent dans le système porte et migrent vers les veinules mésentériques. Les ufs pondus par les femelles traversent la paroi intestinale ou vésicale et sont excrétés dans les selles ou l'urine, mais d'autres ufs sont retenus dans le foie et d'autres organes et sont responsables de la morbi-mortalité de la bilharziose.
La bilharziose représente un problème de santé publique majeur, pour lequel il n'existe qu'un seul traitement recommandé par l'OMS, le praziquantel, mais pas de vaccin. Une meilleure connaissance du génome du schistosome pourrait mettre sur la piste de nouvelles stratégies d'intervention.
L'équipe de Ze-Guang Han (Centre du génome humain national chinois à Shanghai) a séquencé et annoté plus de 13 000 gènes exprimés chez S. japonicum, présent en Asie. Cette espèce possède environ 15 000 gènes ; 35 % des séquences identifiées ne ressemblent à aucun gène connu et 75 % n'ont jamais été décrites chez le schistosome. Parmi les gènes classables, Han et coll. ont trouvé que certains codent pour des protéines similaires aux récepteurs mammifères pour l'insuline, la progestérone et des neuropeptides, ainsi que pour des facteurs permettant peut-être au parasite de se dérober au système immunitaire de l'hôte.
« La bilharziose est un problème très sérieux dans certains pays en développement, y compris en Chine », déclare au « Quotidien » le Dr Ze-Guang Han. « La connaissance du génome de ce parasite devrait permettre de mieux comprendre les interactions schistosome-hôte, les aects biomédicaux de la bilharziose, et l'évolution des invertébrés. De façon intéressante, nous avons trouvé que les vers encodent des récepteurs semblables à ceux des mammifères pour les hormones, les cytokines et les neuropeptides, ce qui suggère que certaines hormones et cytokines de l'hôte pourraient orchestrer le développement et la maturation du schistosome. De plus, les schistosomes peuvent moduler l'attaque immune antiparasitaire de l'hôte à travers des inhibiteurs ou par mimétisme moléculaire et d'autres stratégies d'évasion. Nous projetons maintenant de développer des méthodes moléculaires et sérologiques de diagnostic, ainsi qu'un vaccin. »
L'équipe multicentrique de Sergio Verjovski-Almeida (université de Sao Paulo, Brésil) a, pour sa part, séquencé et analysé 92 % des 14 000 gènes estimés de S. mansoni, lequel est endémique en Amérique du Sud, aux Caraïbes et en Afrique.
L'analyse des séquences de S. mansoni permet une vue détaillée sur d'importants systèmes biologiques du parasite, avec identification de facteurs qui pourraient intervenir dans son développement, sa structure tissulaire, sa mobilité, son système nerveux, son signal intracellulaire, sa maturation sexuelle, sa longévité et sa dérobade face aux réponses immunes de l'hôte.
« Nous avons identifié 350 nouveaux gènes entiers qui s'ajoutent aux 160 gènes déjà connus. De plus, nous avons la séquence partielle de 14 000 nouveaux gènes du schistosome, dont plus de la moitié ne ressemblent à aucun gène connu », précise au « Quotidien » le Dr Verjovski-Almeida.
Des candidats potentiels pour un vaccin
« Nous avons aussi trouvé des candidats potentiels pour un vaccin. Un exemple est la famille de quatre toxines allergéniques du schistosome, similaires aux toxines du venin de la guêpe. Ces toxines pourraient expliquer la réponse allergénique induite par le schistosome chez l'homme. Il est possible que les schistosomes tirent un avantage en interférant avec la réponse immune de l'hôte, en induisant des réactions allergéniques au lieu d'une réaction immunoprotectrice. La connaissance de ces toxines soulève la possibilité d'interférer avec le processus. » L'équipe projette maintenant d'explorer certains des vaccins candidats chez l'animal.
Ces travaux seront aussi exploités pour la recherche de nouveaux traitements. « Le praziquantel, seul médicament recommandé par l'OMS, réduit ou élimine la charge parasitaire chez un humain infecté mais il ne prévient pas la réinfection, qui est fréquente dans de nombreuses régions du monde ou la maladie est endémique », explique le chercheur brésilien. « Notre travail a créé des outils qui devraient ouvrir des voies pour étudier de nouvelles cibles thérapeutiques et des vaccins candidats. »
« Nature Genetics », 16 septembre 2003, http://dx.doi.org/10.1038/ng1236 et http://dx.doi.org/10.1038/ vcf.

Pause exceptionnelle de votre newsletter
En cuisine avec le Dr Dominique Dupagne
[VIDÉO] Recette d'été : la chakchouka
Florie Sullerot, présidente de l’Isnar-IMG : « Il y a encore beaucoup de zones de flou dans cette maquette de médecine générale »
Covid : un autre virus et la génétique pourraient expliquer des différences immunitaires, selon une étude publiée dans Nature