ABILIFY MAINTENA 720 mg, suspension injectable à libération prolongée en seringue préremplie, boîte de 1 seringue préremplie ( 2 aiguilles) de 2,40 ml
Dernière révision : 21/06/2024
Taux de TVA : 2.1%
Prix de vente : 368,20 €
Taux remboursement SS : 65%
Base remboursement SS : 368,20 €
Laboratoire exploitant : OTSUKA PHARMACEUTICAL FRANCE
Abilify Maintena est indiqué dans le traitement d'entretien de la schizophrénie chez les patients adultes stabilisés sous aripiprazole.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Lors d'un traitement antipsychotique, l'amélioration de l'état clinique du patient peut nécessiter plusieurs jours, voire plusieurs semaines. Les patients doivent être étroitement surveillés pendant toute cette période.
Utilisation chez les patients dans un état d'agitation aiguë ou dans un état psychotique grave
Abilify Maintena ne doit pas être utilisé dans la prise en charge des états psychotiques graves ou d'agitation aiguë lorsqu'un contrôle immédiat des symptômes est recherché.
Suicidalité
La survenue d'un comportement suicidaire est inhérente aux psychoses et dans certains cas, elle a été rapportée rapidement après l'instauration ou le changement du traitement antipsychotique, y compris avec l'aripiprazole (voir rubrique Effets indésirables). Une surveillance étroite des patients à haut risque doit accompagner le traitement antipsychotique.
Troubles cardiovasculaires
L'aripiprazole doit être utilisé avec prudence chez les patients atteints d'une maladie cardiovasculaire connue (antécédent d'infarctus du myocarde ou de cardiopathie ischémique, insuffisance cardiaque ou troubles de la conduction), d'une maladie vasculaire cérébrale, de tout état pouvant favoriser une hypotension (déshydratation, hypovolémie et traitement par des médicaments antihypertenseurs) ou une hypertension artérielle, notamment accélérée ou maligne. Des cas d'évènements thromboemboliques vasculaires (ETEV) ont été rapportés avec les antipsychotiques. Comme les patients traités par antipsychotiques présentent souvent des facteurs de risque d'ETEV acquis, tous les facteurs de risque possibles d'ETEV doivent être identifiés avant et pendant le traitement par l'aripiprazole et des mesures préventives doivent être prises (voir rubrique Effets indésirables).
Allongement de l'intervalle QT
Dans les études cliniques avec l'aripiprazole oral, l'incidence de l'allongement du QT était comparable à celle observée sous placebo. L'aripiprazole doit être utilisé avec prudence chez les patients présentant des antécédents familiaux d'allongement du QT (voir rubrique Effets indésirables).
Dyskinésie tardive
Dans les études cliniques de durée inférieure ou égale à un an, des cas peu fréquents de survenue de dyskinésies ont été rapportés au cours du traitement par l'aripiprazole. En cas d'apparition de signes et de symptômes de dyskinésie tardive chez un patient traité par l'aripiprazole, la réduction de la dose, voire l'arrêt du traitement, doit être envisagée (voir rubrique Effets indésirables). Ces symptômes peuvent s'aggraver provisoirement ou même survenir après l'arrêt du traitement.
Syndrome malin des neuroleptiques (SMN)
Le SMN est un syndrome potentiellement mortel associé aux traitements antipsychotiques. Dans les études cliniques, de rares cas de SMN ont été rapportés au cours du traitement par l'aripiprazole. Les signes cliniques du SMN sont l'hyperthermie, la rigidité musculaire, l'altération des facultés mentales et des signes d'instabilité neurovégétative (instabilité du pouls ou de la pression artérielle, tachycardie, hypersudation et troubles du rythme cardiaque). Peuvent s'ajouter des signes comme une augmentation des taux sériques de créatine phosphokinase (CPK), une myoglobinurie (rhabdomyolyse) et une insuffisance rénale aiguë. Cependant, des cas d'élévation des créatines phosphokinases et de rhabdomyolyse n'étant pas nécessairement liées au SMN ont également été rapportés. Lorsqu'un patient présente des signes et symptômes évoquant un SMN, ou une hyperthermie inexpliquée non accompagnée d'autres signes de SMN, tous les antipsychotiques, y compris l'aripiprazole, doivent être arrêtés (voir rubrique Effets indésirables).
Convulsions
Dans les études cliniques, des cas peu fréquents de convulsions ont été rapportés au cours du traitement par l'aripiprazole. Par conséquent, l'aripiprazole doit être utilisé avec prudence chez les patients ayant des antécédents de convulsions ou présentant une affection associée à des convulsions (voir rubrique Effets indésirables).
Patients âgés présentant un état psychotique associé à une démence
Augmentation de la mortalité
Dans trois essais contrôlés avec aripiprazole oral versus placebo chez des patients âgés présentant une psychose associée à la maladie d'Alzheimer (n = 938 ; âge moyen : 82,4 ans ; intervalle : 56 à 99 ans) le risque de décès a été plus élevé chez les patients traités par l'aripiprazole que chez ceux recevant le placebo. Le taux de mortalité dans le groupe des patients traités par aripiprazole était de 3,5 %, contre 1,7 % dans le groupe placebo. Bien que les causes de décès aient été variées, la plupart de ces décès semblaient soit d'origine cardiovasculaire (par exemple, insuffisance cardiaque, mort subite) soit d'origine infectieuse (par exemple, pneumonie) (voir rubrique Effets indésirables).
Effets indésirables cérébrovasculaires
Dans les mêmes études sur l'aripiprazole oral, des effets indésirables vasculaires cérébraux (par exemple, accident vasculaire cérébral, accident ischémique transitoire), dont certains d'évolution fatale, ont été rapportés chez ces patients (âge moyen : 84 ans ; intervalle : 78 à 88 ans). Dans l'ensemble, des effets indésirables vasculaires cérébraux ont été rapportés dans ces essais pour 1,3 % des patients traités par aripiprazole oral et pour 0,6 % des patients traités par placebo. Cette différence n'était pas statistiquement significative. Néanmoins, dans un des essais, une étude à dose fixe, une relation dose-dépendante significative a été observée entre la survenue des effets indésirables vasculaires cérébraux et le traitement par aripiprazole (voir rubrique Effets indésirables).
L'aripiprazole n'est pas indiqué dans le traitement des patients présentant des états psychotiques associés à une démence.
Hyperglycémie et diabète
Une hyperglycémie, dans certains cas sévère et associée à une acidocétose, un coma hyperosmolaire ou un décès, a été rapportée chez les patients traités avec l'aripiprazole. Aucune étude spécifique n'a été menée avec Abilify Maintena chez des patients souffrant d'hyperglycémie ou de diabète. L'obésité et les antécédents familiaux de diabète sont des facteurs de risque pouvant favoriser les complications sévères. Les signes et symptômes d'hyperglycémie (tels que polydipsie, polyurie, polyphagie et asthénie) doivent être recherchés chez les patients traités avec l'aripiprazole. Une surveillance régulière est recommandée afin de détecter toute anomalie de la glycémie chez les patients diabétiques ou ayant des facteurs de risque pouvant favoriser le développement d'un diabète (voir rubrique Effets indésirables).
Hypersensibilité
Des réactions d'hypersensibilité caractérisées par des symptômes allergiques peuvent survenir chez les patients traités par aripiprazole (voir rubrique Effets indésirables).
Prise de poids
Une prise de poids pouvant conduire à des complications graves est souvent observée chez les patients schizophrènes en raison de l'utilisation d'antipsychotiques connus pour entraîner une prise de poids, des comorbidités et une mauvaise hygiène de vie. Une prise de poids a été rapportée chez les patients traités par l'aripiprazole oral après sa commercialisation. Lorsqu'une prise de poids a été observée, il s'agissait généralement de patients qui présentaient des facteurs de risque significatifs tels qu'un antécédent de diabète, un trouble thyroïdien ou un adénome hypophysaire. Dans les études cliniques, l'aripiprazole n'a pas entraîné de prise de poids cliniquement significative (voir rubrique Effets indésirables).
Dysphagie
Des troubles de la motilité œsophagienne et des inhalations du contenu gastrique ont été associés à l'utilisation d'aripiprazole. L'aripiprazole doit être utilisé avec prudence chez les patients à risque de pneumopathie d'inhalation.
Pathologie du jeu et autres troubles du contrôle des impulsions
Les patients peuvent éprouver des impulsions accrues, en particulier pour le jeu, et l'incapacité de contrôler ces impulsions tout en prenant de l'aripiprazole. Les autres impulsions signalées comprennent des pulsions sexuelles accrues, des achats compulsifs, une hyperphagie boulimique ou une alimentation compulsive, et d'autres comportements impulsifs et compulsifs. Il est important pour les prescripteurs d'interroger spécifiquement les patients ou leurs soignants sur le développement de nouvelles impulsions, ou leur augmentation, pour le jeu, des pulsions sexuelles, des achats compulsifs, de l'alimentation excessive ou compulsive ou d'autres impulsions lorsqu'ils sont sous traitement avec de l'aripiprazole. Il convient de noter que les symptômes du trouble du contrôle des impulsions peuvent être associés au trouble sous-jacent ; cependant, dans certains cas, des impulsions ont disparu lorsque la dose a été réduite ou que le médicament a été interrompu. Les troubles du contrôle des impulsions peuvent nuire au patient et à d'autres personnes s'ils ne sont pas reconnus. Une réduction de la dose, voire l'arrêt du médicament, doit être pris en considération si un patient développe de telles impulsions (voir rubrique Effets indésirables).
Chutes
L'aripiprazole peut provoquer somnolence, hypotension orthostatique, instabilité motrice et sensorielle, ce qui peut entraîner des chutes. Des précautions doivent être prises lors du traitement de patients à haut risque, et une dose initiale plus faible doit être envisagée (par exemple, patients âgés ou affaiblis physiquement et/ou psychologiquement, voir rubrique Posologie et mode d'administration).
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu'il est essentiellement « sans sodium ».
Résumé du profil de sécurité
Le profil de sécurité d'Abilify Maintena 960 mg et d'Abilify Maintena 720 mg pour le traitement de la schizophrénie chez les adultes est basé sur des études contrôlées appropriées d'Abilify Maintena 400 mg et d'Abilify Maintena 300 mg. En général, les effets indésirables (EI) observés dans les essais cliniques portant sur Abilify Maintena 960 mg/720 mg étaient similaires à ceux observés dans les essais cliniques portant sur Abilify Maintena 400 mg/300 mg.
Les EI les plus fréquemment observés, rapportés chez ≥ 5 % des patients dans deux essais à long terme conduits en double aveugle avec Abilify Maintena 400 mg/300 mg ont été la prise de poids (9,0 %), l'akathisie (7,9 %) et l'insomnie (5,8 %). Dans les essais cliniques sur Abilify Maintena 960 mg/720 mg, les effets indésirables les plus fréquemment observés ont été la prise de poids (22,7 %), la douleur au site d'injection (18,2 %), l'akathisie (9,8 %), l'anxiété (8,3 %), les céphalées (7,6 %), l'insomnie (7,6 %) et la constipation (6,1 %).
Liste des effets indésirables présentée sous forme de tableau
L'incidence des EI associés au traitement par Abilify Maintena 400 mg/300 mg et Abilify Maintena 960 mg/720 mg est présentée ci-dessous sous forme de tableau. Le tableau est basé sur les effets indésirables rapportés pendant les essais cliniques et/ou l'utilisation après commercialisation.
Tous les effets indésirables sont énumérés par classe de système d'organe et fréquence : très fréquents (≥ 1/10), fréquents (≥ 1/100 à < 1/10), peu fréquents (≥ 1/1 000 à < 1/100), rares (≥ 1/10 000 à < 1/1 000), très rares (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles). À l'intérieur de chaque classe de fréquence, les effets indésirables sont présentés par ordre de gravité décroissante.
Les EI répertoriés sous « fréquence indéterminée » ont été rapportés après la mise sur le marché.
|
Classes de systèmes d'organes |
Fréquent |
Peu fréquent |
Fréquence indéterminée |
|
Affections hématologiques et du système lymphatique |
|
Neutropénie Anémie Thrombopénie Neutrophiles diminués Globules blancs diminués |
Leucopénie |
|
Affections du système immunitaire |
|
Hypersensibilité |
Réaction allergique (par exemple réaction anaphylactique, œdème de Quincke comprenant gonflement de la langue, œdème de la langue, œdème de la face, prurit ou urticaire) |
|
Affections endocriniennes |
|
Prolactinémie diminuée Hyperprolactinémie |
Coma diabétique hyperosmolaire Acidocétose diabétique |
|
Troubles du métabolisme et de la nutrition |
Poids augmentéa Diabète Poids diminué |
Hyperglycémie Hypercholestérolémie Hyperinsulinémie Hyperlipidémie Hypertriglycéridémie Trouble de l'appétit |
Anorexie Appétit diminuéb Hyponatrémie |
|
Affections psychiatriques |
Agitation Anxiété Impatiences Insomnie |
Idées suicidaires Trouble psychotique Hallucination Idée délirante Hypersexualité Réaction de panique Dépression Labilité affective Apathie Dysphorie Trouble du sommeil Bruxisme Diminution de la libido Altération de l'humeur |
Suicide Tentative de suicide Pathologie du jeu Troubles du contrôle des impulsions Hyperphagie boulimique Achats compulsifs Automatisme ambulatoire Nervosité Agressivité |
|
Affections du système nerveux |
Trouble extrapyramidal Akathisie Tremblement Dyskinésie Sédation Somnolence Sensation vertigineuse Céphalée |
Dystonie Dyskinésie tardive Parkinsonisme Perturbation des mouvements Hyperactivité psychomotrice Syndrome des jambes sans repos Rigidité pallidale Hypertonie Bradykinésie Hypersalivation Dysgueusie Parosmie |
Syndrome malin des neuroleptiques État de grand mal épileptique Syndrome sérotoninergique Trouble du langage |
|
Affections oculaires |
|
Crise oculogyre Vision trouble Douleur oculaire Diplopie Photophobie |
|
|
Affections cardiaques |
|
Extrasystoles ventriculaires Bradycardie Tachycardie Onde T d'amplitude diminuée à l'électrocardiogramme Électrocardiogramme anormal Onde T inversée à l'électrocardiogramme |
Mort subite Arrêt cardiaque Torsades de pointes Arythmies ventriculaires QT prolongé |
|
Affections vasculaires |
|
Hypertension Hypotension orthostatique Pression artérielle augmentée |
Syncope Embolie veineuse (y compris embolie pulmonaire et thrombose veineuse profonde) |
|
Affections respiratoires, thoraciques et médiastinales |
|
Toux Hoquet |
Spasme oropharyngé Laryngospasme Pneumonie de déglutition |
|
Affections gastrointestinales |
Bouche sèche |
Reflux gastroœsophagien Dyspepsie Vomissement Diarrhée Nausées Douleur abdominale haute Gêne abdominale Constipation Selles fréquentes Ptyalisme |
Pancréatite Dysphagie |
|
Affections hépatobiliaires |
|
Anomalie du bilan hépatique Enzymes hépatiques augmentées Alanine aminotransférase augmentée Gamma-glutamyl transférase augmentée Bilirubinémie augmentée Aspartate aminotransférase augmentée |
Défaillance hépatique Ictère Hépatite Phosphatase alcaline augmentée |
|
Affections de la peau et du tissu sous-cutané |
|
Alopécie Acné Rosacée Eczéma Induration de la peau |
Rash Réaction de photosensibilité Hyperhidrose Réaction médicamenteuse avec éosinophilie et symptômes systémiques (syndrome DRESS) |
|
Affections musculo- squelettiques et systémiques |
Raideur musculosquelettique |
Rigidité musculaire Contractures musculaires Contractions fasciculaires Tension musculaire Myalgie Extrémités douloureuses Arthralgie Dorsalgie Amplitude articulaire diminuée Rigidité de la nuque Trismus |
Rhabdomyolyse |
|
Affections du rein et des voies urinaires |
|
Néphrolithiase Glycosurie |
Rétention urinaire Incontinence urinaire |
|
Affections gravidiques, puerpérales et périnatales |
|
|
Syndrome de sevrage médicamenteux néonatal |
|
Affections des organes de reproduction et du sein |
Dysérection |
Galactorrhée Gynécomastie Hypersensibilité mammaire Sécheresse vulvovaginale |
Priapisme |
|
Troubles généraux et anomalies au site d'administration |
Douleur au site d'injectiona Induration au site d'injection Fatigue |
Fièvre Asthénie Troubles de la marche Gêne thoracique Réaction au site de l'injection Érythème au point d'injection Gonflement au point d'injection Gêne au niveau du site d'injection Prurit au point d'injection Soif Indolence |
Trouble de la thermorégulation (par exemple hypothermie, fièvre) Douleur thoracique Œdème périphérique |
|
Investigations |
Créatine phosphokinase sanguine augmentée |
Glycémie augmentée Glycémie diminuée Hémoglobine glycosylée augmentée Circonférence de taille augmentée Cholestérolémie diminuée Triglycéridémie diminuée |
Fluctuation du glucose sanguin |
a : rapportés comme très fréquents
dans les essais cliniques sur Abilify Maintena 960 mg/720 mg.
b : rapporté uniquement dans le programme d'essais cliniques d'Abilify Maintena 960 mg/720 mg.
Description d'effets indésirables sélectionnés
Réactions au site d'injection
Le pourcentage de patients dans une étude en ouvert ayant signalé un effet indésirable lié au site d'injection (tous rapportés comme une douleur au site d'injection) était de 18,2 % chez les patients traités par Abilify Maintena 960 mg et de 9,0 % chez les patients traités par Abilify Maintena 400 mg. Dans les deux groupes de traitement, la majorité des douleurs rapportées au site d'injection sont survenues lors de la première injection d'Abilify Maintena 960 mg (21 patients sur 24) ou d'Abilify Maintena 400 mg (7 patients sur 12), ont disparu dans les 5 jours et ont été rapportées avec une fréquence et une gravité décroissantes lors des injections successives. Les scores moyens globaux sur l'échelle visuelle analogique au site d'injection (0 = aucune douleur à 100 = douleur insupportable), permettant aux patients d'évaluer leur douleur, étaient similaires dans les deux groupes de traitement à la dernière injection : 0,8 pré-dose et 1,4 post-dose pour le groupe Abilify Maintena 960 mg contre 1,3 post-dose pour le groupe Abilify Maintena 400 mg.
Neutropénie
Des cas de neutropénie ont été rapportés au cours du développement clinique d'Abilify Maintena 400 mg/300 mg ; ils apparaissaient généralement vers le 16e jour après la première injection et persistaient pendant une durée médiane de 18 jours.
Symptômes extrapyramidaux
Dans les essais réalisés chez des patients stables atteints de schizophrénie, Abilify Maintena 400 mg/300 mg a été associé à une fréquence de symptômes extrapyramidaux supérieure (18,4 %) à celle observée avec l'aripiprazole oral (11,7 %). L'akathisie était le symptôme le plus fréquemment observé (8,2 %) ; elle apparaissait généralement vers le 10e jour après la première injection et persistait pendant une durée médiane de 56 jours. Les patients atteints d'akathisie ont généralement reçu un traitement à base d'un anticholinergique, notamment le mésylate de benzatropine et le trihexyphénidyle. Des médicaments tels que le propranolol et les benzodiazépines (clonazépam et diazépam) ont également été administrés pour contrôler l'akathisie, mais à une fréquence moindre. En termes de fréquence, le parkinsonisme arrivait en seconde position (respectivement 6,9 % pour Abilify Maintena 400 mg/300 mg, 4,2 % pour les comprimés d'aripiprazole [10 mg à 30 mg] et 3,0 % pour le placebo).
Les données issues d'une étude en ouvert menée sur les patients traités par Abilify Maintena 960 mg ont montré un changement minime des scores relatifs aux symptômes extrapyramidaux par rapport à l'inclusion, tel qu'évalué par l'échelle de Simpson-Angus (SAS), l'échelle des mouvements involontaires anormaux (AIMS) et l'échelle d'akathisie de Barnes (BARS). L'incidence des événements liés aux syndromes extrapyramidaux rapportés chez les patients traités par Abilify
Maintena 960 mg était de 18,2 % contre 13,4 % chez les patients traités par Abilify Maintena 400 mg.
Dystonie
Effet de classe : des symptômes de dystonie, contractions anormales prolongées d'un groupe musculaire, peuvent survenir pendant les premiers jours de traitement chez les patients qui y sont prédisposés. Les symptômes dystoniques incluent un spasme des muscles du cou qui peut progresser vers une oppression de la gorge, des difficultés de déglutition, des difficultés respiratoires et/ou une protrusion de la langue. Bien que ces symptômes puissent survenir à faibles doses, ils apparaissent plus fréquemment et avec une plus grande sévérité avec les antipsychotiques de première génération, puissants et fortement dosés. Un risque élevé de dystonie aiguë est observé chez les hommes et les patients jeunes.
Poids
Pendant la phase en double aveugle contrôlée versus produit actif de l'essai à long terme de 38 semaines (voir rubrique Propriétés pharmacodynamiques), l'incidence d'une prise de poids ≥ 7 % entre l'inclusion et la dernière visite a été de 9,5 % pour Abilify Maintena 400 mg/300 mg et de 11,7 % pour les comprimés d'aripiprazole oral (10 mg à 30 mg). L'incidence d'une perte de poids ≥ 7 % entre l'inclusion et la dernière visite a été de 10,2 % pour Abilify Maintena 400 mg/300 mg et de 4,5 % pour les comprimés d'aripiprazole oral (10 mg à 30 mg). Pendant la phase en double aveugle contrôlée versus placebo de l'essai à long terme de 52 semaines (voir rubrique Propriétés pharmacodynamiques), l'incidence d'une prise de poids ≥ 7 % entre l'inclusion et la dernière visite a été de 6,4 % pour Abilify Maintena 400 mg/300 mg et de 5,2 % pour le placebo. L'incidence d'une perte de poids ≥ 7 % entre l'inclusion et la dernière visite a été de 6,4 % pour Abilify Maintena 400 mg/300 mg et de 6,7 % pour le placebo. Pendant le traitement en double aveugle, la variation du poids corporel entre l'inclusion et la dernière visite a été de -0,2 kg pour Abilify Maintena 400 mg/300 mg et de -0,4 kg pour le placebo (p = 0,812).
Dans une étude en ouvert, à doses multiples et randomisée menée chez des patients adultes atteints de schizophrénie (et de trouble bipolaire de type I) dans laquelle la dose administrée tous les 2 mois d'Abilify Maintena 960 mg a été évaluée par rapport à la dose mensuelle d'Abilify Maintena 400 mg, l'incidence globale d'une prise de poids ≥ 7 % par rapport à l'inclusion était comparable entre Abilify Maintena 960 mg (40,6 %) et Abilify Maintena 400 mg (42,9 %). La variation moyenne du poids corporel entre la visite d'inclusion et la dernière visite était de 3,6 kg pour Abilify Maintena 960 mg et de 3,0 kg pour Abilify Maintena 400 mg.
Prolactine
Dans les essais cliniques pour les indications approuvées et après la commercialisation, une augmentation et une diminution du taux de prolactine sérique ont été toutes deux observées par rapport à la valeur à l'inclusion après traitement avec l'aripiprazole (voir rubrique Propriétés pharmacodynamiques).
Pathologie du jeu et autres troubles du contrôle des impulsions
La pathologie du jeu, l'hypersexualité, les achats compulsifs, l'hyperphagie boulimique et la compulsion alimentaire peuvent se manifester chez les patients traités par l'aripiprazole (voir rubrique Mises en garde spéciales et précautions d'emploi).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V.
Le médicament NE DOIT PAS ÊTRE
UTILISE dans la prise en charge des états psychotiques graves ou d'agitation
aiguë lorsqu'un contrôle immédiat des symptômes est recherché.
SURVEILLANCE :
- L'amélioration de l'état clinique du patient peut nécessiter plusieurs jours,
voire plusieurs semaines. Les patients doivent être étroitement surveillés
pendant toute cette période.
- Des signes et symptômes d'hyperglycémie chez les patients traités.
- Du développement de troubles du contrôle des
impulsions.
- Tous les facteurs de risque possibles d'ETEV
doivent être identifiés avant et pendant le traitement et des mesures
préventives doivent être prises.
NOUVEAU-NE DE MÈRE TRAITÉE : les nouveau-nés exposés pendant le troisième
trimestre de la grossesse présentent un risque d'effets indésirables, incluant
des symptômes extrapyramidaux et/ou des symptômes de sevrage, susceptibles de
varier en termes de sévérité et de durée après l'accouchement. Les effets
suivants ont été rapportés : agitation, hypertonie, hypotonie, tremblements,
somnolence, détresse respiratoire, troubles de l'alimentation. En conséquence,
les nouveau-nés doivent être surveillés étroitement.
PREVENIR IMMEDIATEMENT LE MEDECIN en cas de :
- prise de poids, mouvements anormaux, envie de dormir gênant les activités quotidiennes habituelles, difficultés pour avaler ou symptômes allergiques,
- Pensées, idées ou comportements suicidaires, envie de se faire du mal.
- Association des symptômes
suivants, quels qu'ils soient : somnolence excessive, étourdissements,
confusion, désorientation, difficultés à parler, difficultés à marcher, raideur
musculaire ou tremblements, fièvre, faiblesse, irritabilité, agressivité,
anxiété, augmentation de la pression artérielle ou convulsions pouvant
entraîner une perte de conscience.
-
Mouvements anormaux, principalement du visage ou de la bouche.
-
Gonflement, douleur et rougeur d'une jambe : ils peuvent être le signe d'un
caillot sanguin, susceptible de se déplacer dans les vaisseaux sanguins
jusqu'aux poumons et de provoquer une douleur thoracique et des difficultés à
respirer.
-
Association de fièvre, respiration rapide, transpiration, raideur musculaire et
somnolence ou endormissement,
-
Soif inhabituelle, besoin d'uriner plus fréquemment que d'habitude, sensation
de faim importante, sensation de faiblesse ou de fatigue, mal au cœur,
confusion ou odeur fruitée de l'haleine.
PREVENIR
LE MEDECIN en cas de :
- envies ou besoins impérieux d'adopter un comportement qui est inhabituel et impossibilité de résister à l'impulsion, au besoin ou à la tentation d'effectuer des activités qui pourraient être dangereuses (par exemple, dépendance au jeu, prise excessive de nourriture, dépenses excessives, pulsions et obsessions sexuelles anormalement accrues avec une augmentation des pensées et des sensations à caractère sexuel).
PRUDENCE en cas de prise de
boissons alcoolisées et de médicaments contenant de l'alcool (sédation).
EVITER la prise de préparations à base de plantes contenant du millepertuis (Hypericum perforatum).
PRUDENCE en cas de conduite de véhicules ou
d'utilisation de machines (sédation, somnolence, syncope et vision double
ou trouble).
Femmes en âge de procréer
Après une dose unique d'Abilify Maintena, il est attendu que l'exposition plasmatique soit maintenue pendant une durée allant jusqu'à 34 semaines (voir rubrique Propriétés pharmacocinétiques). Il convient de prendre cela en considération lors de l'initiation du traitement chez les femmes en âge de procréer, considérant une éventuelle future grossesse ou allaitement. Abilify Maintena ne doit être utilisé chez les femmes qui prévoient une grossesse qu'en cas de réelle nécessité.
Grossesse
Aucune étude contrôlée spécifique n'a été réalisée avec l'aripiprazole chez la femme enceinte. Des anomalies congénitales ont été rapportées ; cependant, une relation de causalité avec l'aripiprazole n'a pas pu être établie. Les études effectuées chez l'animal n'ont pas pu exclure une toxicité potentielle sur le développement (voir rubrique Données de sécurité préclinique). Les patientes doivent être averties de la nécessité d'informer leur médecin de toute grossesse ou désir de grossesse au cours du traitement par aripiprazole.
Les prescripteurs doivent être conscients de la longue durée d'action d'Abilify Maintena. L'aripiprazole a été détecté dans le plasma de patients adultes jusqu'à 34 semaines après l'administration d'une dose unique de la suspension à libération prolongée.
Les nouveau-nés exposés aux antipsychotiques (dont l'aripiprazole) pendant le troisième trimestre de la grossesse présentent un risque d'effets indésirables, incluant des symptômes extrapyramidaux et/ou des symptômes de sevrage, susceptibles de varier en termes de sévérité et de durée après l'accouchement. Les effets suivants ont été rapportés : agitation, hypertonie, hypotonie, tremblements, somnolence, détresse respiratoire, troubles de l'alimentation. En conséquence, les nouveau-nés doivent être surveillés étroitement (voir rubrique Effets indésirables).
L'exposition maternelle à Abilify Maintena avant et pendant la grossesse peut entraîner des effets indésirables chez le nouveau-né. Abilify Maintena ne doit pas être utilisé pendant la grossesse sauf si cela est absolument nécessaire.
Allaitement
L'aripiprazole et ses métabolites étant excrétés dansle lait maternel, des effets chez les nouveaunés/nourrissons sont probables si Abilify Maintena est administré à des femmes qui allaitent. Étant donné qu'il est attendu qu'une dose unique d'Abilify Maintena reste dans le plasma pendant une durée allant jusqu'à 34 semaines (voir rubrique Propriétés pharmacocinétiques), les nourrissons allaités peuvent être à risque même lorsqu'Abilify Maintena est administré longtemps avant l'allaitement. Les patientes actuellement sous traitement ou qui ont été traitées au cours des 34 dernières semaines par Abilify Maintena ne doivent pas allaiter.
Fertilité
L'aripiprazole n'a pas altéré la fertilité dans les études de toxicité de la reproduction.
Aucune étude d'interaction n'a été réalisée avec Abilify Maintena. Les données ci-dessous sont issues d'études sur l'aripiprazole oral. L'intervalle d'administration de deux mois et la longue demi-vie de l'aripiprazole après l'administration d'Abilify Maintena 960 mg ou 720 mg doivent également être pris en compte lors de l'évaluation d'une éventuelle interaction médicamenteuse.
Du fait de son activité antagoniste des récepteurs α1-adrénergiques, l'aripiprazole peut augmenter l'effet de certains antihypertenseurs.
Compte tenu des principaux effets de l'aripiprazole sur le système nerveux central (SNC), la prudence est recommandée lors de l'association avec l'alcool ou d'autres médicaments à action centrale ayant des effets indésirables qui s'ajoutent à ceux de l'aripiprazole, tels que la sédation (voir rubrique Effets indésirables).
La prudence s'impose en cas d'administration concomitante d'aripiprazole et de médicaments connus pour entraîner un allongement du QT ou un déséquilibre électrolytique.
Effets potentiels d'autres médicaments sur l'aripiprazole
Quinidine et autres inhibiteurs puissants du CYP2D6
Dans une étude clinique chez des volontaires sains, un inhibiteur puissant du CYP2D6 (la quinidine) a augmenté l'ASC de l'aripiprazole pris par voie orale de 107 %, alors que la Cmax était inchangée. L'ASC et la Cmax du métabolite actif, le déhydro-aripiprazole, ont été diminuées respectivement de 32 % et 47 %. D'autres inhibiteurs puissants du CYP2D6, tels que la fluoxétine et la paroxétine, sont susceptibles d'avoir des effets similaires, et par conséquent, les mêmes réductions de dose s'appliquent (voir rubrique Posologie et mode d'administration).
Kétoconazole et autres inhibiteurs puissants du CYP3A4
Dans une étude clinique chez des volontaires sains, un inhibiteur puissant du CYP3A4 (le kétoconazole) a augmenté l'ASC et la Cmax de l'aripiprazole par voie orale respectivement de 63 % et 37 %. L'ASC et la Cmax du déhydro-aripiprazole ont été augmentées respectivement de 77 % et 43 %.
Chez les métaboliseurs lents du CYP2D6, l'utilisation concomitante d'inhibiteurs puissants du CYP3A4 peut conduire à des concentrations plasmatiques plus élevées d'aripiprazole, comparativement aux métaboliseurs rapides du CYP2D6 (voir rubrique Posologie et mode d'administration). L'administration concomitante de kétoconazole ou d'autres inhibiteurs puissants du CYP3A4 et d'aripiprazole ne doit être envisagée que si les bénéfices escomptés sont supérieurs aux risques encourus. D'autres inhibiteurs puissants du CYP3A4, tels que l'itraconazole et les antiprotéases, sont susceptibles d'avoir des effets similaires, et par conséquent, les mêmes réductions de dose sont recommandées (voir rubrique Posologie et mode d'administration). À l'arrêt du traitement par l'inhibiteur du CYP2D6 ou du CYP3A4, la dose d'aripiprazole doit être réaugmentée à la posologie utilisée avant l'initiation du traitement concomitant. Lors de l'utilisation concomitante d'inhibiteurs faibles du CYP3A4 (par exemple le diltiazem) ou du CYP2D6 (par exemple l'escitalopram) et d'aripiprazole, des augmentations modérées des concentrations de l'aripiprazole peuvent être attendues.
Carbamazépine et autres inducteurs du CYP3A4
Après l'administration concomitante de carbamazépine, un inducteur puissant du CYP3A4, et d'aripiprazole oral à des patients atteints de schizophrénie ou de troubles psychotiques, les moyennes géométriques de la Cmax et de l'ASC de l'aripiprazole ont respectivement diminué de68 % et de 73 %, comparativement à l'aripiprazole oral (30 mg) administré seul. De la même façon, les moyennes géométriques de la Cmax et de l'ASC du déhydro-aripiprazole ont respectivement diminué de 69 % et de 71 % après l'administration concomitante d'aripiprazole et de carbamazépine, comparativement à l'aripiprazole oral administré seul. Des effets similaires peuvent être attendus de l'administration concomitante d'Abilify Maintena 960 mg/720 mg et d'autres inducteurs du CYP3A4 (tels que rifampicine, rifabutine, phénytoïne, phénobarbital, primidone, éfavirenz, névirapine et millepertuis). L'utilisation concomitante d'inducteurs du CYP3A4 et d'Abilify Maintena 960 mg/720 mg doit donc être évitée car elle entraînerait une diminution de la concentration sanguine d'aripiprazole, qui pourrait alors être inférieure à la concentration efficace.
Syndrome sérotoninergique
Des cas de syndrome sérotoninergique ont été rapportés chez les patients traités par aripiprazole ; des signes et symptômes potentiels de ce syndrome peuvent survenir, notamment en cas d'utilisation concomitante d'autres médicaments sérotoninergiques, tels que les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ou les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN), ou de médicaments connus pour augmenter les concentrations d'aripiprazole (voir rubrique Effets indésirables).
Posologie
Chez les patients n'ayant jamais pris d'aripiprazole, la tolérance de l'aripiprazole doit être établie avant l'instauration du traitement par Abilify Maintena.
Abilify Maintena ne nécessite pas de titration de la dose.
Protocole d'instauration du traitement
Le schéma posologique recommandé lorsque le patient était jusque-là sous Abilify Maintena 400 mg une fois par mois est une injection d'Abilify Maintena 960 mg au moins 26 jours après l'injection précédente d'Abilify Maintena 400 mg. Abilify Maintena 960 mg doit ensuite être administré une fois tous les 2 mois (tous les 56 jours).
Le traitement peut également être initié en suivant l'un
des deux schémas posologiques supplémentaires :
•
Une injection initiale : le jour de l'initiation après un traitement par
voie orale, une injection d'Abilify Maintena 960 mg doit être administrée et le
traitement avec 10 mg à 20 mg d'aripiprazole oral par jour doit être poursuivi
pendant 14 jours consécutifs afin de maintenir les concentrations
thérapeutiques d'aripiprazole pendant l'initiation du traitement ;
•
Deux injections initiales : le jour de l'initiation après un traitement
par voie orale, une injection d'Abilify Maintena 960 mg et une injection
d'Abilify Maintena 400 mg doivent être administrées dans deux sites d'injection distincts (voir
Mode d'administration), et une dose de 20 mg d'aripiprazole oral doit également
être prise.
Intervalle entre les doses et ajustements posologiques
Après l'instauration du traitement, la dose d'entretien recommandée est une injection d'Abilify Maintena 960 mg une fois tous les deux mois. Injecter Abilify Maintena 960 mg une fois tous les deux mois en une seule injection, 56 jours après l'injection précédente. Les patients peuvent recevoir l'injection jusqu'à 2 semaines avant ou 2 semaines après la dose bimestrielle prévue.
En cas de réactions indésirables à la dose de 960 mg d'Abilify Maintena, une réduction à 720 mg d'Abilify Maintena une fois tous les deux mois doit être envisagée.
Oubli de doses
Si plus de 8 semaines et moins de 14 semaines se sont écoulées depuis la dernière injection, la dose suivante d'Abilify Maintena 960 mg/720 mg doit être administrée dès que possible. Le schéma d'injection une fois tous les deux mois doit alors être repris. Si plus de 14 semaines se sont écoulées depuis la dernière injection, la dose suivante d'Abilify Maintena 960 mg/720 mg doit être administrée en de façon concomitante avec l'aripiprazole oral pendant 14 jours ou en procédant à deux injections séparées (une d'Abilify Maintena 960 mg et l'autre d'Abilify Maintena 400 mg, ou une d'Abilify Maintena 720 mg et l'autre d'Abilify Maintena 300 mg) administrées en même temps qu'une dose de 20 mg d'aripiprazole oral. Le schéma d'administration d'une fois tous les deux mois doit ensuite être repris.
Populations particulières
Patients âgés
La sécurité et l'efficacité d'Abilify Maintena 960 mg/720 mg dans le traitement de la schizophrénie chez les patients âgés de 65 ans ou plus n'ont pas été établies (voir rubrique Mises en garde spéciales et précautions d'emploi). Aucune recommandation sur la posologie ne peut être donnée.
Insuffisance rénale
Aucune adaptation posologique n'est requise pour les patients présentant une insuffisance rénale (voir rubrique Propriétés pharmacocinétiques).
Insuffisance hépatique
Aucune adaptation posologique n'est requise pour les patients présentant une insuffisance hépatique légère ou modérée. Chez les patients présentant une insuffisance hépatique sévère, les données disponibles sont insuffisantes pour établir des recommandations. Chez ces patients, le dosage doit être établi avec prudence. La forme orale est à préférer (voir rubrique Propriétés pharmacocinétiques).
Métaboliseurs lents connus du CYP2D6
Chez les patients connus pour être des métaboliseurs lents
du CYP2D6 :
•
Patients précédemment traités par Abilify Maintena 300 mg une fois par
mois : la dose initiale doit correspondre à une injection d'Abilify Maintena
720 mg, au moins 26 jours après la dernière injection d'Abilify Maintena 300 mg
;
•
Une injection initiale (lorsque le patient était précédemment traité par
voie orale) : la dose initiale doit correspondre à une injection d'Abilify
Maintena 720 mg et le traitement doit être poursuivi avec la dose prescrite
d'aripiprazole oral par jour pendant 14 jours consécutifs ;
•
Deux injections initiales (lorsque le patient était précédemment traité
par voie orale) : la dose initiale doit correspondre à 2 injections séparées ;
une injection d'Abilify Maintena 720 mg et une injection d'Abilify Maintena 300
mg, avec une dose unique de 20 mg d'aripiprazole oral (voir Mode
d'administration).
Par la suite, une dose d'entretien d'Abilify Maintena 720 mg doit être administrée une fois tous les deux mois en une seule injection.
Adaptations de la dose d'entretien liées aux interactions avec les inhibiteurs du CYP2D6 et/ou du CYP3A4 et/ou les inducteurs du CYP3A4
Une adaptation de la dose d'entretien est nécessaire chez les patients prenant de façon concomitante des inhibiteurs puissants du CYP3A4 ou du CYP2D6 pendant plus de 14 jours. Lorsque l'inhibiteur du CYP3A4 ou du CYP2D6 est arrêté, il peut être nécessaire d'augmenter la dose jusqu'à la dose antérieure (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions). En cas de réaction indésirable en dépit des ajustements posologiques d'Abilify Maintena 960 mg, la nécessité d'utiliser un inhibiteur du CYP3A4 ou du CYP2D6 de façon concomitante doit être réévaluée.
L'utilisation concomitante d'inducteurs du CYP3A4 et d'Abilify Maintena 960 mg/720 mg pendant plus de 14 jours doit être évitée ; en effet, dans ce cas, la concentration sanguine d'aripiprazole diminue et peut être inférieure à la concentration efficace (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Abilify Maintena 960 mg/720 mg ne doit pas être utilisé chez les patients connus pour être des métaboliseurs lents du CYP2D6 qui utilisent de façon concomitante un inhibiteur puissant du CYP2D6 et/ou du CYP3A4.
Tableau 1: Adaptation de la dose d'entretien d'Abilify Maintena chez les patients prenant des inhibiteurs puissants du CYP2D6, des inhibiteurs puissants du CYP3A4 et/ou des inducteurs du CYP3A4 pendant plus de 14 jours
|
|
Dose bimestrielle ajustée |
|
Patients prenant Abilify Maintena 960 mg* |
|
|
Inhibiteurs puissants du CYP2D6 ou inhibiteurs puissants du CYP3A4 |
720 mg |
|
Inhibiteurs puissants du CYP2D6 et inhibiteurs puissants du CYP3A4 |
Utilisation d'aripiprazole à éviter |
|
Inducteurs du CYP3A4 |
Utilisation d'aripiprazole à éviter |
|
*Utilisation à éviter chez les patients qui prennent déjà 720 mg, par exemple en raison de réactions indésirables à la dose plus élevée. |
|
Population pédiatrique
La sécurité et l'efficacité d'Abilify Maintena 960 mg/720 mg chez les enfants et les adolescents âgés de 0 à 17 ans n'ont pas été établies. Aucune donnée n'est disponible.
Mode d'administration
Abilify Maintena 960 mg et 720 mg doivent uniquement être utilisés en injection intramusculaire dans le muscle fessier et ne doivent pas être administrés par voie intraveineuse ou sous-cutanée. Ils doivent être administrés uniquement par un professionnel de santé.
La suspension doit être injectée lentement en une seule fois (les doses ne doivent pas être divisées) dans le muscle fessier, en alternant les injections entre le côté droit et le côté gauche. La prudence est recommandée afin d'éviter toute injection accidentelle dans un vaisseau sanguin.
Si le traitement est initié par l'une des options nécessitant deux injections (une injection d'Abilify Maintena 960 mg ou 720 mg, et une injection d'Abilify Maintena 400 mg ou 300 mg), il convient de faire les injections dans deux sites différents. NE PAS faire les deux injections en même temps dans le même muscle fessier.
Les instructions complètes d'utilisation et de manipulation d'Abilify Maintena 960 mg/720 mg sont fournies dans la notice (informations destinées aux professionnels de santé).
Durée de conservation :
3 ans
Précautions particulières de conservation :
Ne pas congeler.
Ce médicament ne doit pas être mélangé avec d'autres médicaments.
Aucun cas de surdosage associé à des effets indésirables n'a été rapporté dans les études cliniques avec l'aripiprazole. Bien que l'expérience avec le surdosage d'aripiprazole soit limitée, parmi les quelques cas de surdosage (accidentel ou intentionnel) rapportés dans les essais cliniques et au cours de l'expérience post-commercialisation avec l'aripiprazole oral, l'ingestion estimée la plus élevée était au total de 1 260 mg sans qu'il n'y ait eu de décès.
L'ampleur possible d'une libération massive de la substance active a été évaluée par simulation des concentrations plasmatiques d'aripiprazole après absorption complète d'une dose de 960 mg d'Abilify Maintena dans la circulation systémique. D'après les résultats de la simulation, en cas de libération massive de la dose, les concentrations d'aripiprazole peuvent atteindre jusqu'à 13,5 fois les concentrations obtenues avec une dose thérapeutique d'Abilify Maintena 960 mg sans libération massive de la substance active. De plus, les concentrations d'aripiprazole après la libération massive de la substance active diminueraient dans les 5 jours pour atteindre les concentrations normalement observées après l'administration d'Abilify Maintena 960 mg.
Signes et symptômes
La prudence est nécessaire pour éviter toute injection accidentelle de ce médicament dans un vaisseau sanguin. En cas de confirmation ou de suspicion d'un surdosage accidentel d'aripiprazole ou d'une administration intraveineuse par inadvertance, une surveillance étroite du patient est nécessaire. Les signes et symptômes pouvant s'avérer importants sur le plan médical et qui ont été observés en cas de surdosage comprenaient une léthargie, une pression artérielle augmentée, une somnolence, une tachycardie, des nausées, des vomissements et de la diarrhée.
Prise en charge du surdosage
Il n'existe pas d'antidote spécifique à l'aripiprazole. La prise en charge du surdosage doit se concentrer sur les soins de soutien, notamment une surveillance et un suivi médicaux étroits. Assurer l'oxygénation et la ventilation adéquates des voies respiratoires. Surveiller le rythme cardiaque et les signes vitaux. Utiliser des mesures de soutien et des mesures symptomatiques. Le traitement doit consister à appliquer les mesures générales en usage dans la prise en charge des surdosages médicamenteux. Envisager la possibilité d'un surdosage de plusieurs médicaments.
La forme à libération prolongée du médicament et la longue demi-vie d'élimination de l'aripiprazole doivent être prises en compte dans l'évaluation des besoins thérapeutiques et lors du rétablissement du patient.
Classe pharmacothérapeutique : Psycholeptiques, autres antipsychotiques, code ATC : N05AX12
Mécanisme d'action
L'efficacité de l'aripiprazole dans la schizophrénie pourrait être due à l'association de son activité agoniste partielle sur les récepteurs dopaminergiques D2 et sérotoninergiques 5-HT1a et de son activité antagoniste sur les récepteurs sérotoninergiques 5-HT2a. L'aripiprazole a montré des propriétés antagonistes dans des modèles animaux d'hyperactivité dopaminergique et des propriétés agonistes dans des modèles d'hypoactivité dopaminergique. L'aripiprazole fait preuve d'une grande affinité in vitro pour les récepteurs dopaminergiques D2 et D3 et sérotoninergiques 5-HT1a et 5-HT2a, et d'une affinité modérée pour les récepteurs dopaminergiques D4, sérotoninergiques 5-HT2c et 5-HT7, α1adrénergiques et histaminiques H1. L'aripiprazole a également montré une affinité modérée pour le site de recapture de la sérotonine, mais n'a pas montré d'affinité notable pour les récepteurs muscariniques cholinergiques. Une interaction avec des récepteurs autres que les sous-types dopaminergiques et sérotoninergiques pourrait expliquer certains autres effets cliniques de l'aripiprazole.
Des doses orales d'aripiprazole allant de 0,5 mg à 30 mg, administrées en une prise quotidienne à des volontaires sains pendant deux semaines, ont entraîné une réduction dose-dépendante de la liaison du 11C-raclopride (un ligand du récepteur D2/D3), détectée par tomographie par émission de positons, au niveau du noyau caudé et du putamen.
Efficacité et sécurité cliniques
Traitement d'entretien de la schizophrénie chez l'adulte
L'efficacité d'Abilify Maintena 960 mg, administré une fois tous les deux mois, a été établie en partie, sur la base d'une étude de comparabilité pharmacocinétique multicentrique, menée en ouvert, randomisée, à doses multiples et à bras parallèles. L'étude a démontré qu'Abilify Maintena 960 mg fournit des concentrations d'aripiprazole similaires, et donc une efficacité similaire, à Abilify Maintena 400 mg sur l'intervalle posologique (voir rubrique Propriétés pharmacocinétiques).
Le tableau 2 présente la similarité des concentrations plasmatiques d'aripiprazole obtenues avec Abilify Maintena 960 mg par rapport à Abilify Maintena 400 mg.
Tableau 2 : Rapport des moyennes géométriques et intervalle de confiance (IC) après la quatrième administration d'Abilify Maintena 960 mg ou les septième et huitième doses d'Abilify Maintena 400 mg dans l'étude en ouvert
|
Paramètre |
Ratio (Abilify Maintena 960 mg/Abilify Maintena 400 mg) |
IC à 90 % |
|
ASC0-56a |
1,006c |
0,851 - 1,190 |
|
C56/C28b |
1,011d |
0,893 - 1,145 |
|
Cmaxb |
1,071c |
0,903 - 1,270 |
a ASC0-56 après la quatrième administration d'Abilify Maintena 960 mg ou la somme des ASC0-28 après les septième et huitième administrations d'Abilify Maintena 400 mg.
b Concentrations plasmatiques d'aripiprazole après la quatrième administration d'Abilify Maintena 960 mg (C56) ou la huitième administration d'Abilify Maintena 400 mg (C28). c Abilify Maintena 960 mg (n = 34), Abilify Maintena 400 mg (n = 32) d Abilify Maintena 960 mg (n = 96), Abilify Maintena 400 mg (n = 82).
L'efficacité d'Abilify Maintena 960 mg/720 mg dans le traitement de la schizophrénie est en outre étayée par l'efficacité établie d'Abilify Maintena 400 mg/300 mg, comme résumé ci-dessous :
Efficacité d'Abilify Maintena 400 mg/300 mg
L'efficacité d'Abilify Maintena 400 mg/300 mg dans le traitement d'entretien de la schizophrénie a été établie dans deux essais randomisés à long terme et en double aveugle.
L'essai pivot était un essai randomisé, en double aveugle, contrôlé versus produit actif, d'une durée de 38 semaines, conçu pour comparer l'efficacité, la sécurité et la tolérance de ce médicament administré en injections mensuelles à celle de l'aripiprazole oral administré en dose unique de 10 mg à 30 mg par jour, dans le traitement d'entretien des patients adultes atteints de schizophrénie. Cet essai comportait une phase de sélection et 3 phases de traitement : phase de conversion, phase de stabilisation orale et phase en double aveugle contrôlée versus produit actif.
662 patients éligibles à la phase en double aveugle versus produit actif ont été randomisés dans un rapport 2 : 2 : 1 au traitement en double-aveugle dans l'un des 3 groupes de traitement : 1) Abilify Maintena, 2) aripiprazole oral en dose de stabilisation de 10 mg à 30 mg, ou 3) aripiprazole injectable à libération prolongée à la dose de 50 mg/25 mg. Le bras aripiprazole 50 mg/25 mg injectable à libération prolongée a été inclus comme à faible dose d'aripiprazole afin de tester la sensibilité de l'analyse de non-infériorité.
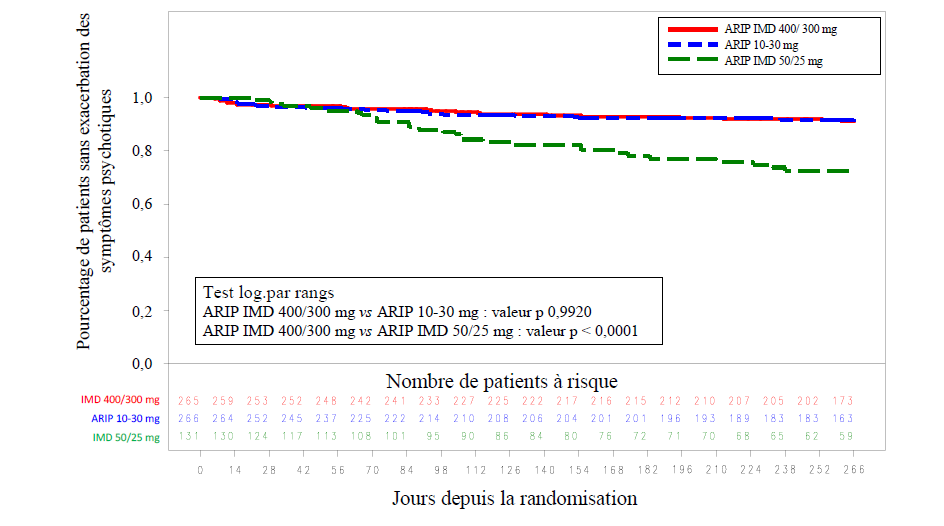
Dans les résultats de l'analyse du critère d'évaluation primaire d'efficacité, le pourcentage estimé de patients présentant une récidive avant la fin de la semaine 26 de la phase en double aveugle contrôlée versus produit actif, a démontré la non-infériorité d'Abilify Maintena 400 mg/300 mg par rapport aux comprimés d'aripiprazole oral (10 mg à 30 mg).
Le taux de récidives estimé à la fin de la semaine 26 était de 7,12 % pour Abilify Maintena 400 mg/300 mg et de 7,76 % pour aripiprazole oral (10 mg à 30 mg/jour), soit une différence de -0,64 %.
L'intervalle de confiance (IC) à 95 % (-5,26 ; 3,99) de la différence du pourcentage estimé de patients présentant des exacerbations des symptômes psychotiques à la fin de la semaine 26 excluait la marge de non-infériorité prédéfinie, à savoir 11,5 %. En conséquence, Abilify Maintena 400 mg/300 mg a démontré une non-infériorité en termes d'efficacité versus la forme comprimé (10 mg à 30 mg).
Le pourcentage estimé de patients présentant une récidive avant la fin de la semaine 26 pour Abilify Maintena 400 mg/300 mg était de 7,12 %, et donc significativement inférieur par rapport à l'aripiprazole injectable à libération prolongée 50 mg/25 mg (21,80 % ; p = 0,0006). La supériorité d'Abilify Maintena 400 mg/300 mg par rapport à l'aripiprazole injectable à libération prolongée 50 mg/25 mg a donc été établie et la validité de la méthodologie de l'essai a été confirmée.
La figure 1 présente les courbes de Kaplan-Meier du délai entre la randomisation et la récidive pendant la phase de traitement en double aveugle contrôlée versus produit actif de 38 semaines pour les groupes Abilify Maintena 400 mg/300 mg, aripiprazole oral 10 mg à 30 mg et aripiprazole injectable à libération prolongée 50 mg/25 mg.
Figure 1 : Courbes de Kaplan-Meier pour le délai d'exacerbation des
symptômes psychotiques
REMARQUE : ARIP IMD 400/300 mg = Abilify Maintena ; ARIP 10 mg à 30 mg = aripiprazole oral ; ARIP IMD 50/25 mg = aripiprazole injectable à libération prolongée
En outre, la non-infériorité d'Abilify Maintena par rapport à l'aripiprazole oral 10 mg à 30 mg est étayée par les résultats de l'analyse du score PANSS (Positive and Negative Syndrome Scale for Schizophrenia).
Tableau 3 : Score PANSS total - Variations entre l'état initial et la semaine 38 - analyse avec imputation de la dernière observation reportée (Last Observation Carried Forward ou LOCF) : échantillon d'efficacité randomiséa, b
|
|
Abilify Maintena 400 mg/300 mg (n = 263) |
Aripiprazole oral 10 mg à 30 mg/jour (n = 266) |
Aripiprazole injectable à libération prolongée 50 mg/25 mg (n = 131) |
|
Moyenne initiale (ET) |
57,9 (12,94) |
56,6 (12,65) |
56,1 (12,59) |
|
Variation moyenne (ET) |
-1,8 (10,49) |
0,7 (11,60) |
3,2 (14,45) |
|
Valeur p |
NA |
0,0272 |
0,0002 |
a Une variation négative du score indique une amélioration.
b Seuls les patients pour lesquels la valeur initiale et au moins une valeur postérieure étaient disponibles ont été inclus. Les valeurs p ont été dérivées de la comparaison de la variation par rapport à la valeur initiale dans une analyse d'un modèle de covariance utilisant le traitement comme terme et la valeur initiale comme covariable.
Le deuxième essai était un essai de retrait randomisé, en double aveugle, d'une durée de 52 semaines, conduit chez des patients américains adultes schizophrènes. Cet essai comportait une phase de sélection et quatre phases de traitement : conversion, stabilisation orale, stabilisation IM et phase en double aveugle contrôlée versus placebo. Les patients répondant aux critères de stabilisation orale pendant la phase de stabilisation orale ont été répartis pour recevoir Abilify Maintena 400 mg/300 mg en simple aveugle et ont commencé une phase de stabilisation par voie IM d'une durée minimale de 12 semaines et d'une durée maximale de 36 semaines. Les patients éligibles à la phase en double aveugle contrôlée versus placebo ont été répartis de façon aléatoire dans un rapport 2/1 pour recevoir respectivement en double aveugle un traitement par Abilify Maintena 400 mg/300 mg ou un placebo.
L'analyse finale de l'efficacité incluait 403 patients randomisés ; 80 patients présentaient une exacerbation des symptômes psychotiques/événements de rechute. Dans le groupe placebo, 39,6 % des patients avaient progressé vers une rechute, alors que dans le groupe Abilify Maintena 400 mg/300 mg une rechute était observée chez 10 % des patients ; les patients du groupe placebo avaient donc un risque 5,03 fois supérieur de présenter une rechute.
Prolactine
Dans la phase en double aveugle contrôlée versus produit actif de 38 semaines, entre l'inclusion et la dernière visite une réduction moyenne du taux de prolactine de -0,33 ng/mL a été observée dans le groupe Abilify Maintena 400 mg/300 mg, contre une augmentation moyenne de 0,79 ng/mL dans le groupe aripiprazole comprimés 10 mg à 30 mg (p < 0,01). L'incidence d'un taux de prolactine supérieur à 1 fois la limite supérieure de la normale (LSN) constatée lors d'un dosage effectué à n'importe quelle visite était de 5,4 % chez les patients sous Abilify Maintena 400 mg/300 mg, contre 3,5 % chez les patients sous comprimés de 10 mg à 30 mg d'aripiprazole oral.
Dans chaque groupe de traitement, l'incidence était généralement plus élevée chez les hommes que chez les femmes.
Dans la phase en double aveugle contrôlée contre placebo de l'essai de 52 semaines, une réduction moyenne du taux de prolactine (-0,38 ng/mL) a été observée entre l'inclusion et la dernière visite dans le groupe Abilify Maintena 400 mg/300 mg, contre une augmentation moyenne dans le groupe placebo (1,67 ng/mL). L'incidence d'un taux de prolactine supérieur à 1 fois la limite supérieure de la normale (LSN) était de 1,9 % chez les patients sous Abilify Maintena 400 mg/300 mg, contre 7,1 % chez les patients sous placebo.
Traitement aigu de la schizophrénie chez les adultes
L'efficacité d'Abilify Maintena 400 mg/300 mg chez les patients adultes atteints de schizophrénie en récidive aiguë a été établie dans une étude à court terme (12 semaines), randomisée, en double aveugle et contrôlée par placebo (n = 339).
Le critère d'évaluation primaire (modification du score total PANSS de la référence à la semaine 10) a montré la supériorité d'Abilify Maintena 400 mg/300 mg (n = 167) par rapport au placebo (n = 172). Similairement au score PANSS total, les deux scores des sous-échelles PANSS positive et négative ont également montré une amélioration (diminution) au cours du temps depuis l'inclusion.
Tableau 4 : Score PANSS total - Variations entre l'état initial et la semaine 10 : échantillon d'efficacité randomisé a
|
|
Abilify Maintena 400 mg/300 mg |
Placebo |
|
Valeur moyenne à l'inclusion (DS) |
102,4 (11,4) n = 162 |
103,4 (11,1) n = 167 |
|
Changement moyen MC (ES) |
-26,8 (1,6) n = 99 |
-11,7 (1,6) n = 81 |
|
Valeur p |
< 0,0001 |
|
|
Différenceb thérapeutique (IC 95 %) |
-15,1 (-19,4, -10,8) |
|
a Les données ont été analysées à l'aide d'un modèle mixte de mesures répétées (MMMR). L'analyse incluait uniquement les sujets qui étaient randomisés pour recevoir le traitement, avaient reçu au moins une injection, présentaient une évaluation d'efficacité à l'inclusion et au moins une post-inclusion.
b Différence (Abilify Maintena moins placebo) de la variation moyenne des moindres carrés par rapport à l'inclusion.
Abilify Maintena 400 mg/300 mg a également montré une amélioration statistiquement significative des symptômes, représentée par la variation du score CGI-S sur l'échelle des impressions cliniques globales pour ce qui est de la sévérité (Clinical Gobal Impressions - Severity) entre l'inclusion et la semaine 10.
Les comportements personnels et sociaux ont été évalués à l'aide de l'échelle de performance personnelle et sociale (PSP). La PSP est une échelle validée notée par les cliniciens qui mesure le comportement personnel et social dans quatre domaines : activités socialement utiles (p. ex. travail et études), relations personnelles et sociales, soins personnels et comportements insolites et agressifs. Abilify Maintena à 400 mg/300 mg a montré une amélioration thérapeutique statistiquement significative en comparaison au placebo à la semaine 10 (+7,1, p < 0,0001, IC 95 % : 4,1, 10,1 en utilisant une analyse ANCOVA (LOCF)).
Le profil de sécurité était cohérent avec le profil connu d'Abilify Maintena 400 mg/300 mg. Néanmoins, il existait des différences entre ce qui avait été observé avec l'utilisation en traitement d'entretien de la schizophrénie. Dans un essai à court terme (12 semaines), randomisé, mené en double aveugle et contrôlé par placebo chez des patients traités avec Abilify Maintena 400 mg/300 mg, les symptômes qui survenaient avec une incidence d'au moins deux fois celle du placebo étaient la prise de poids et l'akathisie. L'incidence de la prise de poids de ≥ 7 % entre l'inclusion et la dernière visite (Semaine 12) était de 21,5 % pour Abilify Maintena 400 mg/300 mg comparé au placebo 8,5 %. L'akathasie était le symptôme EP le plus fréquemment observé (Abilify Maintena 400 mg/300 mg 11,4 % et groupe placebo 3,5 %).
Population pédiatrique
L'Agence européenne des médicaments a accordé une dérogation à l'obligation de soumettre les résultats des études réalisées avec Abilify Maintena dans tous les sous-groupes de population pédiatrique pour la schizophrénie (voir rubrique Posologie et mode d'administration pour les informations concernant l'usage pédiatrique).
Les paramètres pharmacocinétiques de l'aripiprazole après administration d'Abilify Maintena, présentés ci-dessous, sont basés sur l'administration dans le muscle fessier.
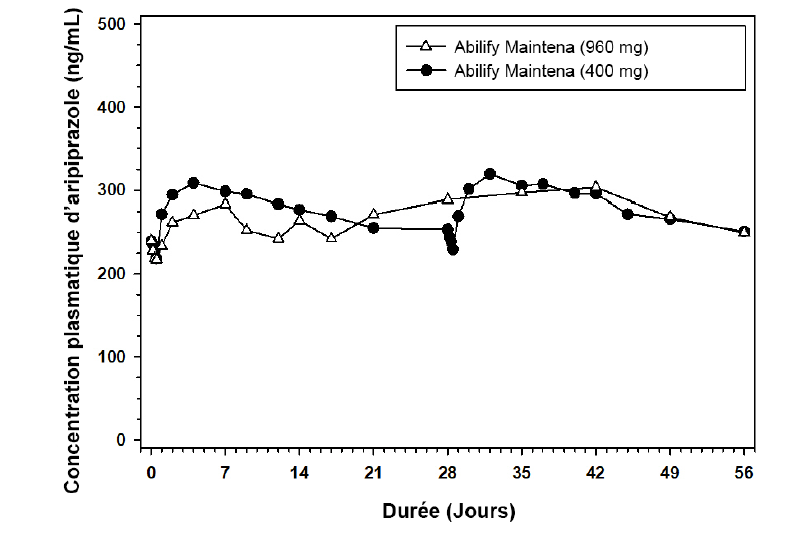
Par rapport à Abilify Maintena 400 mg/300 mg, Abilify Maintena 960 mg/720 mg fournit de l'aripiprazole sur une période de 2 mois. Des doses d'Abilify Maintena de 960 mg et 720 mg, administrées dans le muscle fessier, entraînent des plages d'exposition totale à l'aripiprazole comprises dans la plage d'exposition correspondant aux doses de 300 mg et 400 mg d'Abilify Maintena (administrées une fois par mois), respectivement. De plus, les concentrations plasmatiques maximales moyennes observées (Cmax) et les concentrations plasmatiques d'aripiprazole à la fin de l'intervalle posologique étaient similaires pour Abilify Maintena 960 mg/720 mg par rapport aux doses correspondantes d'Abilify Maintena 400 mg/300 mg (voir rubrique Propriétés pharmacodynamiques).
La concentration plasmatique moyenne d'aripiprazole en fonction du temps après la quatrième administration d'Abilify Maintena 960 mg (n = 102) ou les septième et huitième administrations d'Abilify Maintena 400 mg (n = 93) dans le muscle fessier de patients atteints de schizophrénie (et de trouble bipolaire I) est présentée à la figure 2.
Figure 2 : Concentrations plasmatiques moyennes d'aripiprazole après la quatrième administration d'Abilify Maintena 960 mg (C56) ou les septième et huitième administrations d'Abilify Maintena 400 mg
Absorption/Distribution
L'absorption de l'aripiprazole dans la circulation systémique est lente et prolongée après l'injection dans le muscle fessier en raison de la faible solubilité des particules d'aripiprazole. Le profil de libération de l'aripiprazole d'Abilify Maintena 960 mg/720 mg entraîne des concentrations plasmatiques stables pendant 2 mois après injection(s) dans le muscle fessier. Après administration d'une dose tous les 2 mois unique de 780 mg d'aripiprazole injectable à libération prolongée prêt à l'emploi, la libération de la substance active commence le Jour 1 et dure jusqu'à 34 semaines.
Biotransformation
L'aripiprazole est largement métabolisé par le foie, principalement par trois mécanismes de biotransformation : déhydrogénation, hydroxylation et N-déalkylation. Les études in vitro montrent que les enzymes CYP3A4 et CYP2D6 sont responsables de la déhydrogénation et de l'hydroxylation de l'aripiprazole, la N-déalkylation étant catalysée par CYP3A4. L'aripiprazole est la principale fraction du médicament présente dans la circulation systémique. Après administration de plusieurs doses d'Abilify Maintena 960 mg/720 mg, le métabolite actif, le déhydro-aripiprazole, représente environ 30 % de l'ASC de l'aripiprazole dans le plasma.
Élimination
Après administration orale unique d'aripiprazole marqué au 14C, environ 25 % et 55 % de la radioactivité administrée ont été retrouvés dans les urines et dans les selles, respectivement. Moins de 1 % d'aripiprazole inchangé a été éliminé dans les urines et approximativement 18 % ont été retrouvés inchangés dans les selles.
Pharmacocinétique dans les populations particulières
Aucune étude spécifique n'a été réalisée avec Abilify Maintena dans des groupes de patients particuliers.
Métaboliseurs lents pour le CYP2D6
Sur la base d'une analyse pharmacocinétique de population, les concentrations plasmatiques d'aripiprazole sont environ 2 fois plus élevées chez les métaboliseurs lents du CYP2D6 que chez les métaboliseurs normaux du CYP2D6 (voir rubrique Posologie et mode d'administration).
Patients âgés
Après administration orale, la pharmacocinétique de l'aripiprazole n'est pas différente chez les sujets âgés sains et les adultes plus jeunes. De même, une analyse pharmacocinétique de population n'a pas mis en évidence un effet détectable de l'âge sur la pharmacocinétique de l'aripiprazole chez des patients atteints de schizophrénie.
Sexe
Après administration orale, la pharmacocinétique de l'aripiprazole n'est pas différente chez les sujets sains de sexe masculin et ceux de sexe féminin. De même, une analyse pharmacocinétique de population n'a pas mis en évidence un effet cliniquement pertinent lié au sexe sur la pharmacocinétique de l'aripiprazole dans les essais cliniques réalisés auprès de patients schizophrènes.
Tabagisme
L'évaluation pharmacocinétique de population de l'aripiprazole oral n'a pas révélé d'effets cliniquement pertinents du tabagisme sur la pharmacocinétique de l'aripiprazole.
Origine ethnique
L'évaluation pharmacocinétique de population n'a pas montré de différences liées à l'origine ethnique sur la pharmacocinétique de l'aripiprazole.
Insuffisance rénale
Dans une étude de dose unique avec administration orale d'aripiprazole, les caractéristiques pharmacocinétiques de l'aripiprazole et du déhydro-aripiprazole se sont avérées similaires chez les patients présentant une insuffisance rénale sévère et chez les sujets sains jeunes.
Insuffisance hépatique
Une étude de dose unique avec administration orale d'aripiprazole chez des patients présentant différents degrés de cirrhose hépatique (Child-Pugh classes A, B et C) n'a pas montré d'effet significatif de l'insuffisance hépatique sur la pharmacocinétique de l'aripiprazole et du déhydroaripiprazole. Toutefois, cette étude a inclus seulement 3 patients présentant une cirrhose du foie de classe C, ce qui est insuffisant pour conclure sur leur capacité métabolique.
L'aripiprazole a une influence mineure à modérée sur l'aptitude à conduire des véhicules et à utiliser des machines en raison de ses effets potentiels sur le système nerveux et sur la vue, tels que sédation, somnolence, syncope, vision trouble, diplopie (voir rubrique Effets indésirables).
Le profil toxicologique de l'aripiprazole administré à des animaux de laboratoire par injection intramusculaire est généralement similaire à celui observé après une administration orale à des concentrations plasmatiques comparables. En cas d'injection intramusculaire, une réponse inflammatoire a toutefois été observée au site d'injection ; elle consistait en une inflammation granulomateuse, des foyers (dépôt de la substance active), des infiltrats cellulaires, un œdème (gonflement) et, chez le singe, une fibrose. Ces effets ont disparu progressivement lorsque l'administration a été interrompue.
Les données non cliniques de l'aripiprazole administré par voie orale issues des études conventionnelles de pharmacologie de sécurité, de toxicité à dose répétée, de génotoxicité, du potentiel cancérigène et de toxicité sur la reproduction et le développement n'ont pas révélé de risque particulier pour l'homme.
Aripiprazole oral
Pour l'aripiprazole administré par voie orale, des effets toxicologiquement significatifs ont été observés seulement à des doses ou des expositions largement supérieures à la dose ou l'exposition maximale observée chez l'homme, indiquant que ces effets étaient limités ou sans pertinence pour l'utilisation clinique. Ces effets comprenaient une toxicité corticosurrénalienne dépendante de la dose chez le rat après 104 semaines d'administration orale à environ 3 à 10 fois l'ASC moyenne à l'état d'équilibre à la dose maximale recommandée chez l'homme et une augmentation des carcinomes corticosurrénaliens et des adénomes/carcinomes corticosurrénaliens chez la rate à environ 10 fois l'ASC moyenne à l'état d'équilibre à la dose maximale recommandée chez l'homme. La plus haute exposition non tumorigène chez la rate était environ 7 fois supérieure à l'exposition chez l'homme à la dose recommandée.
Une autre constatation a été une lithiase biliaire résultant de la précipitation de dérivés sulfoconjugués des métabolites hydroxy de l'aripiprazole dans la bile de singes après administration orale répétée de doses allant de 25 mg/kg/jour à 125 mg/kg/jour, soit environ 16 à 81 fois la dose maximale recommandée chez l'homme exprimée en mg/m2.
Toutefois, les concentrations des dérivés sulfoconjugués des métabolites hydroxy de l'aripiprazole dans la bile humaine à la dose la plus forte proposée, soit 30 mg par jour, étaient inférieures ou égales à 6 % des concentrations biliaires retrouvées chez les singes inclus dans l'étude de 39 semaines et bien en deçà (6 %) de leurs limites de solubilité in vitro.
Dans des études à dose répétée menées chez des rats et des chiens juvéniles, le profil toxicologique de l'aripiprazole était comparable à celui observé chez les animaux adultes, et aucune neurotoxicité ou effet indésirable sur le développement n'a été observé.
Sur la base des résultats d'une batterie d'études standards de génotoxicité, l'aripiprazole a été considéré comme non génotoxique chez l'homme. L'aripiprazole n'a pas altéré la fertilité dans les études de toxicité de la reproduction.
Une toxicité sur le développement, comprenant un retard de l'ossification fœtale dépendant de la dose, et d'éventuels effets tératogènes, a été observée chez les rats à des doses correspondant à une exposition infra-thérapeutique (basée sur l'ASC) et chez les lapins à des doses correspondant à une exposition égale à 3 et 11 fois l'ASC moyenne à l'état d'équilibre à la dose maximale recommandée chez l'homme. Une toxicité maternelle a été observée à des doses similaires à celles responsables de la toxicité sur le développement.
Tapoter la seringue dans la main au moins 10 fois. Après l'avoir tapotée, agiter vigoureusement la seringue pendant au moins 10 secondes.
Administration dans le muscle fessier
L'aiguille recommandée pour l'administration dans le muscle fessier est une aiguille de sécurité stérile de calibre 22 de 38 mm (1,5 pouce) ; pour les patients obèses (indice de masse corporelle > 28 kg/m2), une aiguille de sécurité stérile de calibre 21 de 51 mm (2 pouces) doit être utilisée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Les instructions complètes d'utilisation et de manipulation d'Abilify Maintena 960 mg/720 mg sont fournies dans la notice (informations destinées aux professionnels de santé).
Liste I
Suspension injectable à libération prolongée en seringue préremplie.
La suspension est blanche à blanc cassé. Le pH de la suspension est neutre (environ 7,0).
Seringue préremplie (copolymère d'oléfine cyclique) avec un bouchon-piston et un capuchon protecteur en bromobutyle, et une tige de piston et une collerette en polypropylène.
Abilify Maintena 720 mg suspension injectable à libération prolongée en seringue préremplie
Chaque boîte de 720 mg contient une seringue préremplie et deux aiguilles de sécurité stériles : une aiguille de calibre 22 de 38 mm (1,5 pouce) et une aiguille de calibre 21 de 51 mm (2 pouces).
Abilify Maintena 720 mg suspension injectable à libération prolongée en seringue préremplie
Chaque seringue préremplie contient 720 mg d'aripiprazole dans 2,4 mL (300 mg/mL).
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Carmellose sodique
Macrogol
Povidone (E1201)
Chlorure de sodium
Dihydrogénophosphate de sodium monohydraté (E339)
Hydroxyde de sodium (pour l'ajustement du pH) (E524)
Eau pour préparations injectables