MOUNJARO 5 mg-dose KwikPen solution injectable en stylo pré-rempli, boîte de 1 stylo KwikPen de 2,40 ml
Dernière révision : 14/04/2025
Taux de TVA : 10%
Laboratoire exploitant : LILLY FRANCE
Diabète de type 2
Mounjaro est indiqué chez les adultes pour le traitement du diabète de type 2 insuffisamment contrôlé en complément d'un régime alimentaire et d'une activité physique :
- en monothérapie, quand l'utilisation de la metformine est considérée comme inappropriée en raison d'une intolérance ou de contre-indications.
- en association avec d'autres médicaments destinés au traitement du diabète.
Pour les résultats des études concernant les associations, les effets sur le contrôle glycémique ainsi que sur les populations étudiées, voir les rubriques Mises en garde spéciales et précautions d'emploi, Interactions avec d'autres médicaments et autres formes d'interactions et Propriétés pharmacodynamiques.
Contrôle du poids
Mounjaro est indiqué en complément d'un régime hypocalorique et d'une augmentation de l'activité physique dans le contrôle du poids, notamment pour la perte de poids et le maintien du poids, chez des adultes avec un indice de masse corporelle (IMC) initial :
- ≥ 30 kg/m2 (obésité) ou
- ≥ 27 kg/m2 et < 30 kg/m2 (surpoids) en présence d'au moins un facteur de comorbidité lié au poids (par exemple, une hypertension artérielle, une dyslipidémie, un syndrome d'apnéeshypopnées obstructives du sommeil, une maladie cardiovasculaire, un prédiabète ou un diabète de type 2).
Pour les résultats des essais concernant le syndrome d'apnées-hypopnées obstructives du sommeil (SAHOS), voir la rubrique Propriétés pharmacodynamiques.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Pancréatite aiguë
Le tirzépatide n'a pas été étudié chez les patients ayant des antécédents de pancréatite et doit être utilisé avec prudence chez ces patients.
Des cas de pancréatite aiguë ont été rapportés chez des patients traités par tirzépatide.
Les patients doivent être informés des symptômes de la pancréatite aiguë. En cas de suspicion de pancréatite, le traitement par tirzépatide doit être interrompu. Si le diagnostic de pancréatite est confirmé, le traitement par tirzépatide ne doit pas être réinitié. En l'absence d'autres signes et symptômes de pancréatite aiguë, des élévations des enzymes pancréatiques seules ne sont pas prédictives d'une pancréatite aiguë (voir rubrique Effets indésirables).
Hypoglycémie
Les patients traités par tirzépatide en association avec un traitement insulino-sécrétagogue (par exemple, un sulfamide hypoglycémiant) ou de l'insuline peuvent présenter un risque augmenté d'hypoglycémie. Le risque d'hypoglycémie peut être diminué en réduisant la dose du traitement insulino-sécrétagogue ou de l'insuline (voir rubriques Posologie et mode d'administration et Effets indésirables).
Effets gastro-intestinaux
Le tirzépatide a été associé à des effets indésirables gastro-intestinaux, notamment des nausées, des vomissements et des diarrhées (voir rubrique Effets indésirables). Ces effets indésirables peuvent entraîner une déshydratation, qui est susceptible de conduire à une détérioration de la fonction rénale, incluant une insuffisance rénale aiguë. Les patients traités par tirzépatide doivent être avertis du risque potentiel de déshydratation dû aux effets indésirables gastro-intestinaux, et doivent prendre des précautions pour éviter une perte hydrique et des troubles électrolytiques. Cela doit être particulièrement pris en compte chez les personnes âgées, qui peuvent être plus sensibles à de telles complications.
Maladie gastro-intestinale sévère
Le tirzépatide n'a pas été étudié chez les patients ayant une maladie gastro-intestinale sévère, dont la gastroparésie sévère, et doit être utilisé avec prudence chez ces patients.
Rétinopathie diabétique
Le tirzépatide n'a pas été étudié chez les patients atteints de rétinopathie diabétique non proliférante nécessitant un traitement aigu, de rétinopathie diabétique proliférante ou d'œdème maculaire diabétique, et doit être utilisé avec prudence chez ces patients avec une surveillance appropriée.
Aspiration pulmonaire lors d'une anesthésie générale ou d'une sédation profonde
Des cas d'aspiration pulmonaire ont été signalés chez des patients recevant des agonistes du récepteur du GLP-1 lors d'une anesthésie générale ou d'une sédation profonde. Par conséquent, le risque accru de contenu résiduel gastrique dû au retard de vidange gastrique (voir rubrique Effets indésirables) doit être pris en considération avant d'effectuer des procédures sous anesthésie générale ou sédation profonde.
Teneur en sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu'il est essentiellement « sans sodium ».
Alcool benzylique
Ce médicament contient 5,4 mg d'alcool benzylique par dose de 0,6 mL de Mounjaro KwikPen.
Résumé du profil de sécurité
Dans 12 études de phase 3 terminées, 8 158 patients ont été exposés au tirzépatide seul ou en association avec d'autres agents hypoglycémiants. Les effets indésirables les plus fréquemment rapportés ont été des troubles gastro-intestinaux principalement d'intensité légère à modérée. L'incidence des nausées, des diarrhées et des vomissements était plus élevée pendant la période d'escalade de dose puis diminuait au cours du temps (voir rubriques Posologie et mode d'administration et Mises en garde spéciales et précautions d'emploi).
Liste tabulée des effets indésirables
Les effets indésirables suivants sont issus des études cliniques et sont listés par classe de système d'organe et par ordre décroissant de fréquence (très fréquent : ≥ 1/10 ; fréquent : ≥ 1/100, < 1/10 ; peu fréquent : ≥ 1/1 000, < 1/100 ; rare : ≥ 1/10 000, < 1/1 000 ; très rare : < 1/10 000). Dans chaque groupe, les effets indésirables sont classés par ordre décroissant de fréquence.
Tableau 1. Effets indésirables
|
Classe de système d'organe |
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
|
Affections du système immunitaire |
|
Réactions d'hypersensibilité |
|
Réaction anaphylactique#, Angiœdème# |
|
Troubles du métabolisme et de la nutrition |
Hypoglycémie1* en cas d'utilisation avec un sulfamide hypoglycémiant ou de l'insuline |
Hypoglycémie1* en cas d'utilisation avec
la metformine et
un inhibiteur du SGLT2, Diminution de l'appétit1 |
Hypoglycémie1*
en cas d'utilisation
avec la metformine, Perte de poids1 |
|
|
Affections du système nerveux |
|
Sensations vertigineuses2 |
Dysgueusie, Dysesthésie |
|
|
Affections vasculaires |
|
Hypotension2 |
|
|
|
Affections gastrointestinales |
Nausée, Diarrhée, Vomissement3, Douleur abdominale3, Constipation3 |
Dyspepsie, Distension abdominale, Éructation, Flatulence, Reflux gastro-œsophagien |
Lithiase biliaire, Cholécystite, Pancréatite aiguë, Retard de la vidange gastrique |
|
|
Affections de la peau et du tissu sous-cutané |
|
Perte de cheveux2 |
|
|
|
Troubles généraux et anomalies au site d'administration |
|
Fatigue†, Réactions au site d'injection |
Douleur au site d'injection |
|
|
Investigations |
|
Augmentation
de la fréquence cardiaque, Élévation de la lipase, Élévation de l'amylase Augmentation de la calcitonine sérique4 |
|
|
#Rapporté après la commercialisation
*Hypoglycémie définie ci-dessous.
*Hypoglycémie définie ci-dessous.
†Fatigue comprend les termes fatigue,
asthénie, malaise et léthargie.
1 Effet indésirable qui s'applique
uniquement aux patients ayant un diabète de type 2 (DT2).
2 Effet indésirable qui s'applique principalement aux patients en surpoids ou en situation d'obésité, avec ou sans DT2.
2 Effet indésirable qui s'applique principalement aux patients en surpoids ou en situation d'obésité, avec ou sans DT2.
3 La fréquence de survenue de l'effet indésirable était très
fréquente dans les essais dédiés au contrôle du poids et au SAHOS, et fréquente
dans les essais dédiés au DT2.
4 La fréquence de survenue de l'effet indésirable était fréquente
dans les essais dédiés au contrôle du poids, et peu fréquente dans les essais
dédiés au DT2 et au SAHOS.
Description de certains effets indésirables
Réactions d'hypersensibilité
Dans l'ensemble des essais contrôlés versus placebo dédiés au DT2, des réactions d'hypersensibilité ont été rapportées avec le tirzépatide, parfois sévères (par exemple, urticaire et eczéma) ; des réactions d'hypersensibilité ont été rapportées chez 3,2 % des patients traités par tirzépatide et chez 1,7 % des patients traités par placebo. Des cas rares de réaction anaphylactique et d'angiœdème ont été rapportés après la commercialisation du tirzépatide.
Dans 3 essais contrôlés versus placebo dédiés au contrôle du poids et dans 2 essais contrôlés versus placebo dédiés au SAHOS, des réactions d'hypersensibilité ont été rapportées avec le tirzépatide, parfois sévères (par exemple, éruption cutanée et dermatite) ; des réactions d'hypersensibilité ont été rapportées chez 3,0 - 5,0 % des patients traités par tirzépatide et chez 2,1 - 3,8 % des patients traités par placebo.
Hypoglycémie chez les patients ayant un diabète de type 2
Études dédiées au
diabète de type 2
Une hypoglycémie cliniquement
significative (glycémie < 3,0 mmol/L (< 54 mg/dL) ou une hypoglycémie sévère
(nécessitant l'assistance d'une tierce personne)) est survenue chez 10 à 14 %
des patients (0,14 à 0,16 événements/patient-année) lorsque le tirzépatide a
été ajouté à un sulfamide hypoglycémiant et chez 14 à 19 % des patients (0,43 à
0,64 événements/patient-année) lorsque le tirzépatide a été ajouté à l'insuline
basale.
Le taux d'hypoglycémies cliniquement significatives avec l'administration du tirzépatide en monothérapie ou en association avec d'autres médicaments antidiabétiques oraux ne dépassait pas 0,04 événement/patient-année (voir tableau 1 et rubriques Posologie et mode d'administration, Mises en garde spéciales et précautions d'emploi et Propriétés pharmacodynamiques).
Dans les études cliniques de phase 3, 10 patients (0,2 %) ont rapporté 12 épisodes d'hypoglycémie sévère. Parmi ces 10 patients, 5 (0,1 %) étaient sous insuline glargine ou un sulfamide hypoglycémiant et ont rapporté 1 épisode chacun.
Étude dédiée au
contrôle du poids
Dans un essai de phase 3 contrôlé
versus placebo dédié au contrôle du poids chez des patients avec DT2, une
hypoglycémie (glycémie < 3,0 mmol/L (< 54 mg/dL)) a été rapportée chez
4,2 % des patients traités par tirzépatide contre 1,3 % des patients traités
par placebo. Dans cet essai, les patients prenant du tirzépatide en association
avec un sécrétagogue de l'insuline (par exemple, un sulfamide hypoglycémiant)
présentaient une incidence d'hypoglycémie plus élevée (10,3 %) par rapport aux
patients traités par tirzépatide ne prenant pas de sulfamide hypoglycémiant
(2,1 %). Aucun épisode d'hypoglycémie sévère n'a été signalé.
Réactions indésirables gastro-intestinales
Dans les études de phase 3 contrôlées versus placebo dédiées au DT2, les troubles gastro-intestinaux ont été augmentés de manière dose-dépendante dans les groupes tirzépatide 5 mg (37,1 %), 10 mg (39,6 %) et 15 mg (43,6 %) par rapport au placebo (20,4 %). Des nausées sont survenues chez respectivement 12,2 %, 15,4 % et 18,3 % versus 4,3 % des patients et des diarrhées chez respectivement 11,8 %, 13,3 % et 16,2 % versus 8,9 % des patients, dans les groupes tirzépatide 5 mg, 10 mg et 15 mg versus placebo. Les effets indésirables gastro-intestinaux étaient principalement d'intensité légère (74 %) ou modérée (23,3 %). L'incidence des nausées, des vomissements et des diarrhées était plus élevée pendant la période d'escalade de dose et diminuait au cours du temps.
Plus de patients ont arrêté définitivement le traitement en raison de la survenue d'un évènement gastro-intestinal dans les groupes tirzépatide 5 mg (3,0 %), 10 mg (5,4 %) et 15 mg (6,6 %) par rapport au groupe placebo (0,4 %).
Dans une étude de phase 3 contrôlée versus placebo dédiée au contrôle du poids chez des patients sans DT2, les troubles gastro-intestinaux étaient augmentés dans les groupes tirzépatide 5 mg (55,6 %), 10 mg (60,8 %) et 15 mg (59,2 %) par rapport au placebo (30,3 %). Des nausées sont survenues chez respectivement 24,6 %, 33,3 % et 31,0 % versus 9,5 % des patients et des diarrhées chez respectivement 18,7 %, 21,2 % et 23,0 % versus 7,3 % des patients, dans les groupes tirzépatide 5 mg, 10 mg et 15 mg versus placebo. Les effets indésirables gastro-intestinaux étaient principalement d'intensité légère (60,8 %) ou modérée (34,6 %). L'incidence des nausées, des vomissements et des diarrhées était plus élevée pendant la période d'escalade de dose et diminuait au cours du temps.
Plus de patients ont arrêté définitivement le traitement de l'étude en raison de la survenue d'un évènement gastro-intestinal dans les groupes tirzépatide 5 mg (1,9 %), 10 mg (4,4 %) et 15 mg (4,1 %) par rapport au groupe placebo (0,5 %).
Événements liés à la vésicule biliaire
Dans 3 études de phase 3 contrôlées versus placebo dédiées au contrôle du poids, l'incidence globale de cholécystite et de cholécystite aiguë était respectivement de 0,6 % et de 0,2 % chez les patients traités par tirzépatide et par placebo.
Dans 3 études de phase 3 contrôlées versus placebo dédiées au contrôle du poids et dans 2 études de phase 3 contrôlées versus placebo dédiées au syndrome d'apnées-hypopnées obstructives du sommeil (SAHOS), une maladie aiguë de la vésicule biliaire a été rapportée chez jusqu'à 2,0 % des patients traités par tirzépatide et chez jusqu'à 1,6 % des patients traités par placebo.
Dans les études de phase 3 dédiées au contrôle du poids, les événements aigus de la vésicule biliaire étaient positivement corrélés à la perte de poids.
Immunogénicité
Il n'a été constaté aucun signe d'altération du profil pharmacocinétique ni aucune incidence sur l'efficacité du tirzépatide liés au développement d'anticorps anti-médicaments (AAM) ou d'anticorps neutralisants.
Dans les études cliniques de phase 3 dédiées au DT2, la présence d'AAM a été recherchée chez 5 025 patients traités par tirzépatide. Parmi eux, 51,1 % ont développé des AAM apparus au cours de la période de traitement. Chez 38,3 % des patients évalués, les AAM apparus pendant le traitement étaient persistants (les AAM apparus pendant le traitement sont restés présents pendant une période de 16 semaines ou plus). Des anticorps neutralisants contre l'activité du tirzépatide sur les récepteurs du GIP (polypeptide insulinotrope dépendant du glucose) et du GLP-1 (peptide-1 apparenté au glucagon) étaient retrouvés chez respectivement 1,9 % et 2,1 % des patients, et des anticorps neutralisants dirigés contre le GIP natif et le GLP-1 natif étaient retrouvés chez respectivement 0,9 % et 0,4 % des patients.
Dans les 4 études de phase 3 dédiées au contrôle du poids et les 2 études de phase 3 dédiées au SAHOS, la présence d'AAM a été recherchée chez 3 710 patients traités par tirzépatide. Parmi eux, 60,6 - 65,1 % ont développé des AAM apparus au cours de la période de traitement. Chez 46,5 - 51,3 % des patients évalués, les AAM apparus pendant le traitement étaient persistants. Des anticorps neutralisants contre l'activité du tirzépatide sur les récepteurs du GIP et du GLP-1 étaient retrouvés chez jusqu'à respectivement 2,3 % et 2,3 % des patients, et des anticorps neutralisants dirigés contre le GIP natif et le GLP-1 natif étaient retrouvés chez jusqu'à 0,7 % et 0,1 % des patients respectivement.
Fréquence cardiaque
Dans les études de phase 3 contrôlées versus placebo dédiées au DT2, le traitement par tirzépatide a entraîné une augmentation moyenne maximale de la fréquence cardiaque de 3 à 5 battements par minute. L'augmentation moyenne maximale de la fréquence cardiaque chez les patients sous placebo était de 1 battement par minute.
Le pourcentage de patients ayant présenté une modification par rapport à l'inclusion de la fréquence cardiaque > 20 bpm pendant 2 visites consécutives ou plus était de respectivement 2,1 %, 3,8 % et 2,9 % pour le tirzépatide 5 mg, 10 mg et 15 mg, contre 2,1 % pour le placebo.
De légères augmentations moyennes de l'intervalle PR ont été observées avec le tirzépatide par rapport au placebo (augmentation moyenne de 1,4 à 3,2 msec et diminution moyenne de 1,4 msec respectivement). Aucune différence n'a été observée pour les arythmies et les troubles de la conduction cardiaque apparus sous traitement entre le tirzépatide 5 mg, 10 mg, 15 mg et le placebo (respectivement 3,8 %, 2,1 %, 3,7 % et 3 %).
Dans 3 études de phase 3 contrôlées versus placebo dédiées au contrôle du poids, le traitement par tirzépatide a entraîné une augmentation moyenne de la fréquence cardiaque de 3 battements par minute. Il n'y a pas eu d'augmentation moyenne de la fréquence cardiaque chez les patients traités par placebo.
Dans une étude contrôlée versus placebo dédiée au contrôle du poids chez des patients sans DT2, le pourcentage de patients ayant présenté une modification par rapport à l'inclusion de la fréquence cardiaque > 20 bpm pendant 2 visites consécutives ou plus était de respectivement 2,4 %, 4,9 % et 6,3 % pour le tirzépatide 5 mg, 10 mg et 15 mg, contre 1,2 % pour le placebo.
De légères augmentations moyennes de l'intervalle PR ont été observées avec le tirzépatide et le placebo (augmentation moyenne de 0,3 à 1,4 msec et de 0,5 msec respectivement). Aucune différence n'a été observée pour les arythmies et les troubles de la conduction cardiaque apparus sous traitement entre le tirzépatide 5 mg, 10 mg, 15 mg et le placebo (respectivement 3,7 %, 3,3 %, 3,3 % et 3,6 %).
Réactions au site d'injection
Dans les études de phase 3 contrôlées versus placebo dédiées au DT2, les réactions au site d'injection ont été augmentées pour le tirzépatide (3,2 %) par rapport au placebo (0,4 %).
Dans 3 études de phase 3 contrôlées versus placebo dédiées au contrôle du poids et 2 études de phase 3 contrôlées versus placebo dédiées au SAHOS, les réactions au site d'injection ont été augmentées pour le tirzépatide (8,0 - 8,6 %) par rapport au placebo (1,8 - 2,6 %).
Globalement, dans les études de phase 3, les signes et symptômes de réactions au site d'injection les plus fréquemment rapportés étaient des érythèmes et des prurits. L'intensité maximale des réactions au site d'injection chez les patients était légère (91 %) ou modérée (9 %). Aucune réaction au site d'injection n'était grave.
Enzymes pancréatiques
Dans les études de phase 3 contrôlées versus placebo dédiées au DT2, le traitement par tirzépatide a entraîné des augmentations moyennes de 33 % à 38 % de l'amylase pancréatique et de 31 % à 42 % de la lipase pancréatique par rapport à l'inclusion. Les patients sous placebo ont présenté une augmentation de 4 % de l'amylase par rapport à l'inclusion et aucune variation n'a été observée pour la lipase.
Dans 3 études de phase 3 contrôlées versus placebo dédiées au contrôle du poids et 2 études de phase 3 contrôlées versus placebo dédiées au SAHOS, le traitement par tirzépatide a entraîné des augmentations moyennes de 23 - 24,6 % de l'amylase pancréatique et de 34 - 39 % de la lipase pancréatique par rapport à l'inclusion. Les patients sous placebo ont présenté une augmentation de 0,7 - 1,8 % de l'amylase et de 3,5 - 5,7 % de la lipase par rapport à l'inclusion.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V
CONSULTER immédiatement un médecin en cas de :
- Douleur sévère qui persiste dans l'estomac et le dos.
- Problèmes respiratoires, gonflement rapide des lèvres, de la langue
et/ou de la gorge avec des difficultés à avaler et un rythme cardiaque
rapide.
Femme en âge de procréer :
- Il est recommandé d'utiliser un moyen de CONTRACEPTION pendant le traitement.
- En cas de PROJET DE GROSSESSE le traitement par tirzépatide doit être interrompu au moins 1 mois avant.
PREVENIR L'ANESTHESISTE de la prise du traitement en cas d'intervention chirurgicale programmée.
Femmes en âge de procréer
Il est recommandé aux femmes en âge de procréer d'utiliser une contraception lorsqu'elles sont traitées par tirzépatide.
Grossesse
Il n'existe peu ou pas de données concernant l'utilisation du tirzépatide chez la femme enceinte. Les études chez les animaux ont mis en évidence une toxicité sur la reproduction (voir rubrique Données de sécurité préclinique). L'utilisation du tirzépatide n'est pas recommandée pendant la grossesse et chez les femmes en âge de procréer n'utilisant pas de contraception. En cas de projet de grossesse ou en cas de grossesse, le traitement par tirzépatide doit être interrompu. Le tirzépatide doit être arrêté au moins 1 mois avant un projet de grossesse en raison de sa longue demi-vie (voir rubrique Propriétés pharmacocinétiques).
Allaitement
L'excrétion de tirzépatide dans le lait maternel est inconnue. Un risque pour le nouveau-né/nourrisson ne peut être exclu.
Une décision doit être prise soit d'interrompre l'allaitement soit d'interrompre/de s'abstenir d'utiliser le tirzépatide en prenant en compte le bénéfice de l'allaitement pour l'enfant au regard du bénéfice du traitement pour la femme.
Fertilité
L'effet du tirzépatide sur la fertilité chez l'homme est inconnu.
Les études chez l'animal avec le tirzépatide n'ont pas mis en évidence d'effets délétères directs sur la fertilité (voir rubrique Données de sécurité préclinique).
Le tirzépatide retarde la vidange gastrique et est donc susceptible d'influer sur le taux d'absorption des médicaments administrés par voie orale de façon concomitante. Cet effet, entraînant une diminution de la Cmax et un retard du tmax, est plus prononcé au moment de l'instauration du traitement par tirzépatide.
Sur la base des résultats d'une étude avec du paracétamol, qui a été utilisé comme médicament modèle pour évaluer l'effet du tirzépatide sur la vidange gastrique, aucun ajustement de la posologie n'est attendu pour la plupart des médicaments administrés concomitamment par voie orale. Cependant, il est recommandé de surveiller les patients prenant des médicaments oraux ayant un index thérapeutique étroit (par exemple, warfarine, digoxine), en particulier au début du traitement par tirzépatide et après une augmentation de dose. Le risque d'effet différé doit également être pris en compte pour les médicaments oraux pour lesquels un délai d'action rapide est important.
Paracétamol
Après l'administration d'une dose unique de 5 mg de tirzépatide, la concentration plasmatique maximale (Cmax) du paracétamol a été réduite de 50 % et la médiane (tmax) a été retardée d'1 heure. L'effet du tirzépatide sur l'absorption orale du paracétamol dépend de la dose et du temps. À faibles doses (0,5 et 1,5 mg), il n'y a eu qu'une modification mineure de l'exposition au paracétamol. Après quatre prises hebdomadaires consécutives de tirzépatide (5/5/8/10 mg), aucun effet n'a été observé sur la Cmax et le tmax du paracétamol. L'exposition totale (ASC) n'a pas été affectée. Aucun ajustement de la dose de paracétamol n'est nécessaire lorsqu'il est administré avec le tirzépatide.
Contraceptifs oraux
L'administration d'un contraceptif oral combiné (0,035 mg d'éthinylestradiol plus 0,25 mg de norgestimate, un promédicament de la norelgestromine) en présence d'une dose unique de tirzépatide (5 mg) a entraîné une réduction de la Cmax et de l'aire sous la courbe (ASC) du contraceptif oral. La Cmax de l'éthinylestradiol a été réduite de 59 % et l'ASC de 20 % avec un retard du tmax de 4 heures. La Cmax de la norelgestromine a été réduite de 55 % et l'ASC de 23 % avec un retard du tmax de 4,5 heures. La Cmax du norgestimate a été réduite de 66 % et l'ASC de 20 % avec un retard du tmax de 2,5 heures. Cette réduction de l'exposition après une dose unique de tirzépatide n'est pas considérée comme cliniquement pertinente. Aucun ajustement de la dose des contraceptifs oraux n'est nécessaire.
Posologie
La dose initiale de tirzépatide est de 2,5 mg une fois par semaine. Après 4 semaines, la dose doit être augmentée à 5 mg une fois par semaine. Si nécessaire, des augmentations de dose peuvent être effectuées par paliers de 2,5 mg après un minimum de 4 semaines à la dose en cours.
Les doses d'entretien recommandées sont de 5 mg, 10 mg et 15 mg.
La dose maximale est de 15 mg une fois par semaine.
Lorsque le tirzépatideest ajouté à un traitement en cours par metformine et/ou inhibiteur du cotransporteur de sodium-glucose de type 2 (iSGLT2), la dose en cours de metformine et/ou d'iSGLT2 peut être conservée.
Lorsque le tirzépatide est ajouté à un traitement en cours par sulfamide hypoglycémiant et/ou insuline, une diminution de la dose de sulfamide hypoglycémiant ou d'insuline peut être envisagée afin de réduire le risque d'hypoglycémie. Une auto-surveillance glycémique est nécessaire pour ajuster la dose de sulfamide hypoglycémiant et d'insuline. L'adoption d'une approche progressive de la réduction de la dose d'insuline est recommandée (voir rubriques Mises en garde spéciales et précautions d'emploi et Effets indésirables).
Doses oubliées
En cas d'oubli, la dose doit être administrée le plus rapidement possible dans les 4 jours suivant la dose oubliée. Si plus de 4 jours se sont écoulés, la dose oubliée ne doit pas être administrée et la dose suivante doit être administrée le jour normalement prévu. Dans tous les cas, les patients peuvent ensuite reprendre leur schéma posologique hebdomadaire habituel.
Modification du schéma d'administration
Le jour de la semaine prévu pour l'injection peut être éventuellement modifié, à condition que l'intervalle entre deux doses soit d'au moins 3 jours.
Populations particulières
Patients
âgés, sexe, race, origine ethnique ou poids corporel
Aucun ajustement de la dose n'est nécessaire en
fonction de l'âge, du sexe, de la race, de l'origine ethnique ou du poids
corporel (voir rubriques Propriétés pharmacodynamiques et Propriétés pharmacocinétiques). Seules des données très limitées sont
disponibles chez les patients âgés de ≥ 85 ans.
Insuffisants
rénaux
Aucun ajustement de la dose n'est requis chez les
patients présentant une insuffisance rénale, y compris une insuffisance rénale
terminale (IRT). L'expérience de l'utilisation du tirzépatide chez les patients
présentant une insuffisance rénale sévère et une IRT est limitée. La prudence
s'impose lors du traitement de ces patients par tirzépatide (voir rubrique
Propriétés pharmacocinétiques).
Insuffisants
hépatiques
Aucun ajustement de la dose n'est requis chez les
patients atteints d'insuffisance hépatique. L'expérience de l'utilisation du
tirzépatide chez les patients présentant une insuffisance hépatique sévère est
limitée. La prudence s'impose lors du traitement de ces patients par
tirzépatide (voir rubrique Propriétés pharmacocinétiques).
Population
pédiatrique
La sécurité et l'efficacité du tirzépatide chez les
enfants âgés de moins de 18 ans n'ont pas encore été établies. Aucune donnée
n'est disponible.
Mode d'administration
Mounjaro doit être administré par injection sous-cutanée dans l'abdomen, la cuisse ou le haut du bras.
La dose peut être administrée à toute heure de la journée, au moment ou en dehors des repas.
Les sites d'injection doivent être alternés à chaque administration. Si un patient s'injecte également de l'insuline, il doit injecter Mounjaro dans un site d'injection différent.
Il doit être conseillé aux patients de lire attentivement les instructions d'utilisation incluses dans la notice avant d'administrer le médicament.
Flacon
Les patients et leurs soignants doivent être formés à la technique d'injection sous-cutanée avant d'administrer Mounjaro.
Pour plus d'informations avant administration, voir la rubrique Précautions particulières d’élimination et de manipulation.
Durée de conservation :
Stylo pré-rempli (KwikPen), multidose
Avant
utilisation
2 ans
Après
la première utilisation
30 jours. À conserver en dehors du réfrigérateur à une
température ambiante inférieure à 30 °C. Le stylo pré-rempli KwikPen doit être
jeté 30 jours après la première utilisation.
Précautions particulières de conservation :
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
Stylo pré-rempli (KwikPen), multidose
Pour les conditions de conservation du médicament après la première utilisation, voir la rubrique Durée de conservation.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé à d'autres médicaments.
En cas de surdosage, un traitement symptomatique approprié doit être mis en place en fonction des signes cliniques et des symptômes du patient. Les patients peuvent présenter des réactions indésirables gastro-intestinales, notamment des nausées. Il n'existe aucun antidote spécifique à un surdosage de tirzépatide. Une période d'observation prolongée et un traitement de ces symptômes peuvent s'avérer nécessaires, en tenant compte de la demi-vie du tirzépatide (environ 5 jours).
Classe pharmacothérapeutique : Médicaments utilisés
dans le traitement du diabète, médicaments hypoglycémiants, à l'exclusion des
insulines, Code ATC : A10BX16
Mécanisme d'action
Le tirzépatide est un agoniste des récepteurs du GIP et du GLP-1 à action prolongée, hautement sélectif vis-à-vis des récepteurs du GIP et du GLP-1 humains. Le tirzépatide a une forte affinité avec les récepteurs du GIP et du GLP-1. L'activité du tirzépatide sur le récepteur du GIP est similaire à celle du GIP natif. L'activité du tirzépatide sur le récepteur du GLP-1 est inférieure à celle du GLP-1 natif. Les deux récepteurs sont exprimés sur les cellules endocrines α et β du pancréas, dans le cœur, le système vasculaire, les cellules immunitaires (leucocytes), les intestins et les reins. Les récepteurs du GIP sont également exprimés sur les adipocytes.
De plus, les récepteurs du GIP et du GLP-1 sont exprimés dans des zones du cerveau importantes pour la régulation de l'appétit. Des études chez l'animal montrent que le tirzépatide se distribue et active des neurones des régions du cerveau impliquées dans la régulation de l'appétit et de la prise alimentaire. Des études chez l'animal montrent que le tirzépatide peut moduler l'utilisation des graisses via le récepteur du GIP. Dans les adipocytes humains cultivés in vitro, le tirzépatide agit sur les récepteurs du GIP pour réguler la captation du glucose et moduler la captation des lipides et la lipolyse.
Contrôle glycémique
Le tirzépatide améliore le contrôle glycémique en abaissant les concentrations de glucose à jeun et postprandiales chez les patients ayant un diabète de type 2, par le biais de plusieurs mécanismes.
Régulation de l'appétit et métabolisme énergétique
Le tirzépatide réduit le poids corporel et la masse grasse corporelle. La perte de poids corporel est principalement due à une réduction de la masse grasse. Les mécanismes associés à la réduction du poids corporel et de la masse grasse corporelle impliquent une diminution de l'apport alimentaire grâce à la régulation de l'appétit. Des études cliniques montrent que le tirzépatide réduit l'apport énergétique et l'appétit en augmentant la sensation de satiété et de rassasiement, et en réduisant la sensation de faim. Le tirzépatide réduit également l'intensité des envies alimentaires et les préférences pour les aliments riches en sucres et en graisses. Le tirzépatide module l'utilisation des graisses.
Effets pharmacodynamiques
Sécrétion d'insuline
Le tirzépatide augmente la sensibilité au glucose des cellules β du pancréas. Il améliore la première et la seconde phase de la sécrétion d'insuline de manière glucose-dépendante.
Dans une étude de clamp hyperglycémique chez des patients ayant un diabète de type 2, le tirzépatide a été comparé à un placebo et au sémaglutide 1 mg, un agoniste sélectif des récepteurs du GLP-1, en termes de sécrétion d'insuline. Le tirzépatide 15 mg a amélioré l'insulinosécrétion de première et seconde phase de respectivement 466 % et 302 % par rapport à l'inclusion. Il n'a été observé aucune variation de l'insulinosécrétion de première et seconde phase pour le placebo.
Sensibilité à l'insuline
Le tirzépatide améliore la sensibilité à l'insuline.
Le tirzépatide 15 mg a amélioré de 63 % la sensibilité à l'insuline du corps entier, évaluée par la valeur M, une mesure de l'absorption tissulaire du glucose à l'aide d'un clamp euglycémique hyperinsulinémique. La valeur M est restée inchangée pour le placebo.
Chez les patients en situation d'obésité ou en surpoids, et chez les patients ayant un diabète de type 2 (quel que soit le poids corporel), le tirzépatide entraîne une perte de poids qui est susceptible de contribuer à l'amélioration de la sensibilité à l'insuline.
Concentration de glucagon
Le tirzépatide a réduit les concentrations de glucagon à jeun et postprandiales de manière glucosedépendante. Le tirzépatide 15 mg a réduit la concentration de glucagon à jeun de 28 % et l'ASC du glucagon après un repas mixte de 43 %, comparativement à une absence de variation pour le placebo.
Vidange gastrique
Le tirzépatide retarde la vidange gastrique, ce qui peut ralentir l'absorption du glucose après les repas et avoir un effet bénéfique sur la glycémie postprandiale. Le retard de la vidange gastrique induit par le tirzépatide diminue avec le temps.
Efficacité et sécurité cliniques
Diabète de type 2
La sécurité et l'efficacité du tirzépatide ont été évaluées dans cinq études internationales contrôlées et randomisées de phase 3 (SURPASS 1 à 5) ayant comme objectif principal l'évaluation du contrôle glycémique. Les études ont inclus 6 263 patients traités, ayant un diabète de type 2 (4 199 traités par tirzépatide). Les objectifs secondaires incluaient le poids corporel, le pourcentage de patients atteignant les objectifs de perte de poids, la glycémie à jeun et le pourcentage de patients ayant atteint l'HbA1c cible. Les cinq études de phase 3 ont évalué le tirzépatide 5 mg, 10 mg et 15 mg. Tous les patients traités par tirzépatide ont commencé avec une dose de 2,5 mg pendant 4 semaines. Ensuite, la dose de tirzépatide a été augmentée de 2,5 mg toutes les 4 semaines jusqu'à ce qu'ils aient atteint la dose qui leur était assignée.
Dans toutes les études, le traitement par tirzépatide a montré des réductions durables, statistiquement significatives et cliniquement pertinentes par rapport à l'inclusion de l'HbA1c comme objectif principal comparativement au placebo ou au traitement par comparateur actif (sémaglutide, insuline dégludec et insuline glargine) pendant une durée allant jusqu'à 1 an. Dans une étude, ces effets se sont maintenus jusqu'à 2 ans. Des réductions statistiquement significatives et cliniquement pertinentes du poids corporel par rapport à l'inclusion ont aussi été démontrées. Les résultats des études de phase 3 sont présentés ci-dessous d'après les données de traitement hors traitement de secours dans la population en intention de traiter modifiée (modified intent-to-treat, mITT) composée de tous les patients randomisés ayant été exposés à au moins 1 dose du traitement à l'étude, à l'exclusion des patients ayant arrêté le traitement à l'étude en raison d'une inclusion par erreur.
SURPASS-1 - Monothérapie
Dans une étude contrôlée versus placebo en double aveugle d'une durée de 40 semaines, 478 patients présentant un contrôle glycémique inadéquat avec un régime alimentaire et de l'exercice physique ont été randomisés pour recevoir du tirzépatide 5 mg, 10 mg ou 15 mg une fois par semaine ou un placebo. L'âge moyen des patients était de 54 ans et 52 % étaient des hommes. À l'inclusion, la durée moyenne de leur diabète était de 5 ans et l'IMC moyen était de 32 kg/m2.
Tableau 2. SURPASS-1 : Résultats à la semaine 40
|
|
Tirzépatide 5 mg |
Tirzépatide 10 mg |
Tirzépatide 15 mg |
Placebo |
|
|
Population mITT (n) |
121 |
121 |
120 |
113 |
|
|
HbA1c (%) |
À l'inclusion (moyenne) |
7,97 |
7,88 |
7,88 |
8,08 |
|
Variation depuis l'inclusion |
-1,87## |
-1,89## |
-2,07## |
+0,04 |
|
|
Différence par rapport au placebo [IC 95 %] |
-1,91** [-2,18 ; -1,63] |
-1,93** [-2,21 ; -1,65] |
-2,11** [-2,39 ; -1,83] |
- |
|
|
HbA1c (mmol/mol) |
À l'inclusion (moyenne) |
63,6 |
62,6 |
62,6 |
64,8 |
|
Variation depuis l'inclusion |
-20,4## |
-20,7## |
-22,7## |
+0,4 |
|
|
Différence par rapport au placebo [IC 95 %] |
-20,8** [-23,9 ; -17,8] |
-21,1** [-24,1 ; -18,0] |
-23,1** [-26,2 ; -20,0] |
- |
|
|
Patients (%) atteignant une HbA1c |
< 7 % |
86,8** |
91,5** |
87,9** |
19,6 |
|
≤ 6,5 % |
81,8†† |
81,4†† |
86,2†† |
9,8 |
|
|
< 5,7 % |
33,9** |
30,5** |
51,7** |
0,9 |
|
|
Glycémie à jeun (mmol/L) |
À l'inclusion (moyenne) |
8,5 |
8,5 |
8,6 |
8,6 |
|
Variation depuis l'inclusion |
-2,4## |
-2,6## |
-2,7## |
+0,7# |
|
|
Différence par rapport au placebo [IC 95 %] |
-3,13** [-3,71 ; -2,56] |
-3,26** [-3,84 ; -2,69] |
-3,45** [-4,04 ; -2,86] |
- |
|
|
Glycémie à jeun (mg/dL) |
À l'inclusion (moyenne) |
153,7 |
152,6 |
154,6 |
155,2 |
|
Variation depuis l'inclusion |
-43,6## |
-45,9## |
-49,3## |
+12,9# |
|
|
Différence par rapport au placebo [IC 95 %] |
-56,5** [-66,8 ; -46,1] |
-58,8** [-69,2 ; -48,4] |
-62,1** [-72,7 ; -51,5] |
- |
|
|
Poids corporel (kg) |
À l'inclusion (moyenne) |
87,0 |
85,7 |
85,9 |
84,4 |
|
Variation depuis l'inclusion |
-7,0## |
-7,8## |
-9,5## |
-0,7 |
|
|
Différence par rapport au placebo [IC 95 %] |
-6,3** [-7,8 ; -4,7] |
-7,1** [-8,6 ; -5,5] |
-8,8** [-10,3 ; -7,2] |
- |
|
|
Patients (%) atteignant une perte de poids |
≥ 5 % |
66,9†† |
78,0†† |
76,7†† |
14,3 |
|
≥ 10 % |
30,6†† |
39,8†† |
47,4†† |
0,9 |
|
|
≥ 15 % |
13,2† |
17,0† |
26,7† |
0,0 |
|
†p < 0,05, †† p < 0,001 pour la comparaison au placebo, non ajusté pour tests multiples.
#p < 0,05, ## p < 0,001 pour la comparaison par rapport à l'inclusion, non ajusté pour tests multiples.
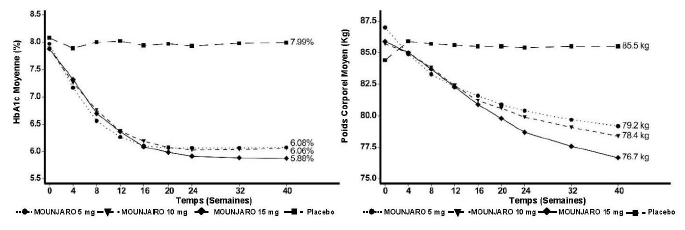
Figure 1. HbA1c moyenne (%) et poids corporel moyen (kg) de l'inclusion à la semaine 40
SURPASS-2 - En association avec la metformine
Dans une étude en ouvert d'une durée de 40 semaines contrôlée versus comparateur actif (en double aveugle pour l'attribution de la dose de tirzépatide), 1 879 patients ont été randomisés pour recevoir du tirzépatide 5 mg, 10 mg ou 15 mg une fois par semaine ou du sémaglutide 1 mg une fois par semaine, tous en association avec la metformine. L'âge moyen des patients était de 57 ans et 47 % étaient des hommes. À l'inclusion, la durée moyenne de leur diabète était de 9 ans et l'IMC moyen était de 34 kg/m2.
Tableau 3. SURPASS-2 : Résultats à la semaine 40
|
|
Tirzépatide 5 mg |
Tirzépatide 10 mg |
Tirzépatide 15 mg |
Sémaglutide 1 mg |
|
|
Population mITT (n) |
470 |
469 |
469 |
468 |
|
|
HbA1c (%) |
À l'inclusion (moyenne) |
8,33 |
8,31 |
8,25 |
8,24 |
|
Variation depuis l'inclusion |
-2,09## |
-2,37## |
-2,46## |
-1,86## |
|
|
Différence par rapport au sémaglutide [IC 95 %] |
-0,23** [-0,36 ; -0,10] |
-0,51** [-0,64 ; -0,38] |
-0,60** [-0,73 ; -0,47] |
- |
|
|
HbA1c (mmol/mol) |
À l'inclusion (moyenne) |
67,5 |
67,3 |
66,7 |
66,6 |
|
Variation depuis l'inclusion |
-22,8## |
-25,9## |
-26,9## |
-20,3## |
|
|
Différence par rapport au sémaglutide [IC 95 %] |
-2,5** [-3,9 ; -1,1] |
-5,6** [-7,0 ; -4,1] |
-6,6** [-8,0 ; -5,1] |
N/A |
|
|
Patients (%) atteignant une HbA1c |
< 7 % |
85,5* |
88,9** |
92,2** |
81,1 |
|
≤ 6,5 % |
74,0† |
82,1†† |
87,1†† |
66,2 |
|
|
< 5,7 % |
29,3†† |
44,7** |
50,9** |
19,7 |
|
|
Glycémie à jeun (mmol/L) |
À l'inclusion (moyenne) |
9,67 |
9,69 |
9,56 |
9,49 |
|
Variation depuis l'inclusion |
-3,11## |
-3,42## |
-3,52## |
-2,70## |
|
|
Différence par rapport au sémaglutide [IC 95 %] |
-0,41† [-0,65 ; -0,16] |
-0,72†† [-0,97 ; -0,48] |
-0,82†† [-1,06 ; -0,57] |
- |
|
|
Glycémie à jeun (mg/dL) |
À l'inclusion (moyenne) |
174,2 |
174,6 |
172,3 |
170,9 |
|
Variation depuis l'inclusion |
-56,0## |
-61,6## |
-63,4## |
-48,6## |
|
|
Différence par rapport au sémaglutide [IC 95 %] |
-7,3† [-11,7 ; -3,0] |
-13,0†† [-17,4 ; -8,6] |
-14,7†† [-19,1 ; -10,3] |
- |
|
|
Poids corporel (kg) |
À l'inclusion (moyenne) |
92,6 |
94,9 |
93,9 |
93,8 |
|
Variation depuis l'inclusion |
-7,8## |
-10,3## |
-12,4## |
-6,2## |
|
|
Différence par rapport au sémaglutide [IC 95 %] |
-1,7** [-2,6 ; -0,7] |
-4,1** [-5,0 ; -3,2] |
-6,2** [-7,1 ; -5,3] |
- |
|
|
Patients (%) atteignant une perte de poids |
≥ 5 % |
68,6† |
82,4†† |
86,2†† |
58,4 |
|
≥ 10 % |
35,8†† |
52,9†† |
64,9†† | 25,3 |
|
|
≥ 15 % |
15,2† |
27,7†† |
39,9†† | 8,7 |
|
†p < 0,05, †† p < 0,001 pour la comparaison au sémaglutide 1 mg, non ajusté pour tests multiples.
#p < 0,05, ## p < 0,001 pour la comparaison par rapport à l'inclusion, non ajusté pour tests multiples.
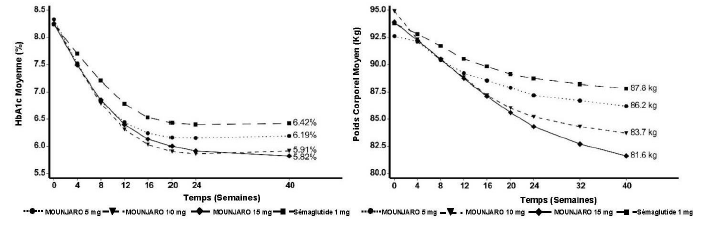
Figure 2. HbA1c moyenne (%) et poids corporel moyen (kg) de l'inclusion à la semaine 40
SURPASS-3 - En association avec la metformine, avec ou sans iSGLT2
Dans une étude en ouvert d'une durée de 52 semaines contrôlée versus comparateur actif, 1 444 patients ont été randomisés pour recevoir du tirzépatide 5 mg, 10 mg ou 15 mg une fois par semaine ou de l'insuline dégludec, tous en association avec la metformine avec ou sans iSGLT2. 32 % des patients utilisaient un iSGLT2 à l'inclusion. À l'inclusion, les patients avaient un diabète depuis 8 ans en moyenne, un IMC moyen de 34 kg/m2,un âge moyen de 57 ans et 56 % étaient des hommes.
Les patients traités par insuline dégludec ont démarré à une dose de 10 unités/jour qui a été ajustée selon un algorithme ciblant une glycémie à jeun < 5 mmol/L. La dose moyenne d'insuline dégludec à la semaine 52 était de 49 unités/jour.
Tableau 4. SURPASS-3 : Résultats à la semaine 52
|
|
Tirzépatide 5 mg |
Tirzépatide 10 mg |
Tirzépatide 15 mg |
Insuline dégludec titrée |
|
|
Population mITT (n) |
358 |
360 |
358 |
359 |
|
|
HbA1c (%) |
À l'inclusion (moyenne) |
8,17 |
8,19 |
8,21 |
8,13 |
|
Variation depuis l'inclusion |
-1,93## |
-2,20## |
-2,37## |
-1,34## |
|
|
Différence par rapport à l'insuline dégludec [IC 95 %] |
-0,59** [-0,73 ; -0,45] |
-0,86** [-1,00 ; -0,72] |
-1,04** [-1,17 ; -0,90] |
- |
|
|
HbA1c (mmol/mol) |
À l'inclusion (moyenne) |
65,8 |
66,0 |
66,3 |
65,4 |
|
Variation depuis l'inclusion |
-21,1## |
-24,0## |
-26,0## |
-14,6## |
|
|
Différence par rapport à l'insuline dégludec [IC 95 %] |
-6,4** [-7,9 ; -4,9] |
-9,4** [-10,9 ; -7,9] |
-11,3** [-12,8 ; -9,8] |
- |
|
|
Patients (%) atteignant une HbA1c |
< 7 % |
82,4** |
89,7** |
92,6** |
61,3 |
|
≤ 6,5 % |
71,4†† |
80,3†† |
85,3†† |
44,4 |
|
|
< 5,7 % |
25,8†† |
38,6†† |
48,4†† |
5,4 |
|
|
Glycémie à jeun (mmol/L) |
À l'inclusion (moyenne) |
9,54 |
9,48 |
9,35 |
9,24 |
|
Variation depuis l'inclusion |
-2,68## |
-3,04## |
-3,29## |
-3,09## |
|
|
Différence par rapport à l'insuline dégludec [IC 95 %] |
0,41† [0,14 ; 0,69] |
0,05 [-0,24 ; 0,33] |
-0,20 [-0,48 ; 0,08] |
- |
|
|
Glycémie à jeun (mg/dL) |
À l'inclusion (moyenne) |
171,8 |
170,7 |
168,4 |
166,4 |
|
Variation depuis l'inclusion |
-48,2## |
-54,8## |
-59,2## |
-55,7## |
|
|
Différence par rapport à l'insuline dégludec [IC 95 %] |
7,5† [2,4 ; 12,5] |
0,8 [-4,3 ; 5,9] |
-3,6 [-8,7 ; 1,5] |
- |
|
|
Poids corporel (kg) |
À l'inclusion (moyenne) |
94,5 |
94,3 |
94,9 |
94,2 |
|
Variation depuis l'inclusion |
-7,5## |
-10,7## |
-12,9## |
+2,3## |
|
|
Différence par rapport à l'insuline dégludec [IC 95 %] |
-9,8** [-10,8 ; -8,8] |
-13,0** [-14,0 ; -11,9] |
-15,2** [-16,2 ; -14,2] |
- |
|
|
Patients (%) atteignant une perte de poids |
≥ 5 % |
66,0†† |
83,7†† |
87,8†† |
6,3 |
|
≥ 10 % |
37,4†† |
55,7†† |
69,4†† |
2,9 |
|
|
≥ 15 % |
12,5†† |
28,3†† |
42,5†† |
0,0 |
|
†p < 0,05, †† p < 0,001 pour la comparaison à l'insuline dégludec, non ajusté pour tests multiples.
#p < 0,05, ## p < 0,001 pour la comparaison par rapport à l'inclusion, non ajusté pour tests multiples.
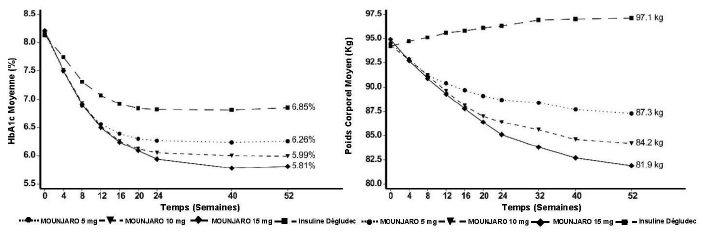
Figure 3. HbA1c moyenne (%) et du poids corporel moyen (kg) de l'inclusion à la semaine 52
Mesure
en continu du glucose (MCG)
Un sous-ensemble de patients (N = 243) a participé à
une évaluation du profil glycémique sur 24 heures capturé par MCG en aveugle. À
52 semaines, les patients traités par tirzépatide (doses combinées de 10 mg et
15 mg) ont passé significativement plus de temps avec des valeurs de glucose
dans la plage euglycémique définie comme 71 à 140 mg/dL (3,9 à 7,8 mmol/L) par
rapport aux patients traités par insuline dégludec, avec respectivement 73 % et
48 % de la période des 24 heures.
SURPASS-4 - En association avec 1-3 antidiabétiques oraux : metformine, sulfamideshypoglycémiants ou iSGLT2
Dans une étude en ouvert contrôlée versus comparateur actif d'une durée allant jusqu'à 104 semaines (critère principal d'évaluation à 52 semaines), 2 002 patients ayant un diabète de type 2 et à risque cardiovasculaire augmenté ont été randomisés pour recevoir du tirzépatide 5 mg, 10 mg ou 15 mg une fois par semaine ou de l'insuline glargine une fois par jour en complément de leur traitement par metformine (95 %) et/ou sulfamides hypoglycémiants (54 %) et/ou iSGLT2 (25 %). À l'inclusion, les patients avaient un diabète depuis 12 ans en moyenne, un IMC moyen de 33 kg/m2,un âge moyen de 64 ans et 63 % étaient des hommes. Les patients traités par insuline glargine ont démarré à une dose de 10 unités/jour qui a été ajustée selon un algorithme ciblant une glycémie à jeun < 5,6 mmol/L. La dose moyenne d'insuline glargine à la semaine 52 était de 44 unités/jour.
Tableau 5. SURPASS-4 : Résultats à la semaine 52
|
|
Tirzépatide 5 mg |
Tirzépatide 10 mg |
Tirzépatide 15 mg |
Insuline glargine titrée |
|
|
Population mITT (n) |
328 |
326 |
337 |
998 |
|
|
52 semaines |
|||||
|
HbA1c (%) |
À l'inclusion (moyenne) |
8,52 |
8,60 |
8,52 |
8,51 |
|
Variation depuis l'inclusion |
-2,24## |
-2,43## |
-2,58## |
-1,44## |
|
|
Différence par rapport à l'insuline glargine [IC 95 %] |
-0,80** [-0,92 ; -0,68] |
-0,99** [-1,11 ; -0,87] |
-1,14** [-1,26 ; -1,02] |
- |
|
|
HbA1c (mmol/mol) |
À l'inclusion (moyenne) |
69,6 |
70,5 |
69,6 |
69,5 |
|
Variation depuis l'inclusion |
-24,5## |
-26,6## |
-28,2## |
-15,7## |
|
|
Différence par rapport à l'insuline glargine [IC 95 %] |
-8,8** [-10,1 ; -7,4] |
-10,9** [-12,3 ; -9,6] |
-12,5** [-13,8 ; -11,2] |
- |
|
|
Patients (%) atteignant une HbA1c |
< 7 % |
81,0** |
88,2** |
90,7** |
50,7 |
|
≤ 6,5 % |
66,0†† |
76,0†† |
81,1†† |
31,7 |
|
|
< 5,7 % |
23,0†† |
32,7†† |
43,1†† |
3,4 |
|
|
Glycémie à jeun (mmol/L) |
À l'inclusion (moyenne) |
9,57 |
9,75 |
9,67 |
9,37 |
|
Variation depuis l'inclusion |
-2,80## |
-3,06## |
-3,29## |
-2,84## |
|
|
Différence par rapport à l'insuline glargine [IC 95 %] |
0,04 [-0,22 ; 0,30] |
-0,21 [-0,48 ; 0,05] |
-0,44†† [-0,71 ; -0,18] |
- |
|
|
Glycémie à jeun (mg/dL) |
À l'inclusion (moyenne) |
172,3 |
175,7 |
174,2 |
168,7 |
|
Variation depuis l'inclusion |
-50,4## |
-54,9## |
-59,3## |
-51,4## |
|
|
Différence par rapport à l'insuline glargine [IC 95 %] |
1,0 [-3,7 ; 5,7] |
-3,6 [-8,2 ; 1,1] |
-8,0†† [-12,6 ; -3,4] |
- |
|
|
Poids corporel (kg) |
À l'inclusion (moyenne) |
90,3 |
90,7 |
90,0 |
90,3 |
|
Variation depuis l'inclusion |
-7,1## |
-9,5## |
-11,7## |
+1,9## |
|
|
Différence par rapport à l'insuline glargine [IC 95 %] |
-9,0** [-9,8 ; -8,3] |
-11,4** [-12,1 ; -10,6] |
-13,5** [-14,3 ; -12,8] |
- |
|
|
Patients (%) atteignant une perte de poids |
≥ 5 % |
62,9†† |
77,6†† |
85,3†† |
8,0 |
|
≥ 10 % |
35,9†† |
53,0†† |
65,6†† |
1,5 |
|
|
≥ 15 % |
13,8†† |
24,0†† |
36,5†† |
0,5 |
|
†p < 0,05, †† p < 0,001 pour la comparaison à l'insuline glargine, non ajusté pour tests multiples.
#p < 0,05, ## p < 0,001 pour la comparaison par rapport à l'inclusion, non ajusté pour tests multiples.
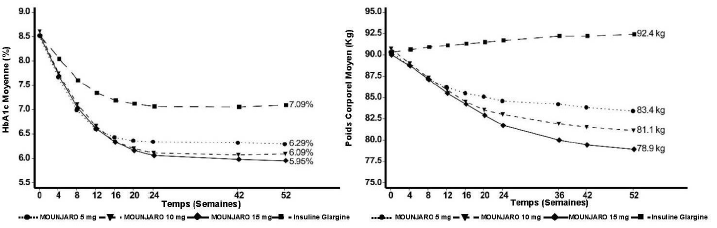
Figure 4. HbA1c moyenne (%) et poids corporel moyen (kg) de l'inclusion à la semaine 52
SURPASS-5 - En association avec de l'insuline basale titrée, avec ou sans metformine
Dans une étude contrôlée versus placebo en double
aveugle d'une durée de 40 semaines, 475 patients présentant un contrôle
glycémique insuffisant sous insuline glargine avec ou sans metformine ont été
randomisés pour recevoir du tirzépatide 5 mg, 10 mg ou 15 mg une fois par
semaine ou un placebo. Les doses d'insuline glargine ont été ajustées selon un
algorithme ciblant une glycémie à jeun < 5,6 mmol/L. À l'inclusion, les patients avaient
un diabète depuis 13 ans en moyenne, un IMC moyen de 33 kg/m2, un
âge moyen de 61 ans et 56 % étaient des hommes. La dose médiane globale estimée
d'insuline glargine à l'inclusion était de 34 unités/jour. La dose médiane
d'insuline glargine à la semaine 40 était de 38, 36, 29 et 59 unités/jour pour
les patients recevant respectivement le tirzépatide 5 mg, 10 mg, 15 mg et le
placebo.
Tableau 6. SURPASS-5 : Résultats à la semaine 40
|
|
Tirzépatide 5 mg |
Tirzépatide 10 mg |
Tirzépatide 15 mg |
Placebo |
|
|
Population mITT (n) |
116 |
118 |
118 |
119 |
|
|
HbA1c (%) |
À l'inclusion (moyenne) |
8,29 |
8,34 |
8,22 |
8,39 |
|
Variation depuis l'inclusion |
-2,23## |
-2,59## |
-2,59## |
-0,93## |
|
|
Différence par rapport au placebo [IC 95 %] |
-1,30** [-1,52 ; -1,07] |
-1,66** [-1,88 ; -1,43] |
-1,65** [-1,88 ; -1,43] |
- |
|
|
HbA1c (mmol/mol) |
À l'inclusion (moyenne) |
67,1 |
67,7 |
66,4 |
68,2 |
|
Variation depuis l'inclusion |
-24,4## |
-28,3## |
-28,3## |
-10,2## |
|
|
Différence par rapport au placebo [IC 95 %] |
-14,2** [-16,6 ; -11,7] |
-18,1** [-20,6 ; -15,7] |
-18,1** [-20,5 ; -15,6] |
- |
|
|
Patients (%) atteignant une HbA1c |
< 7 % |
93,0** |
97,4** |
94,0** |
33,9 |
|
≤ 6,5 % |
80,0†† |
94,7†† |
92,3†† |
17,0 |
|
|
< 5,7 % |
26,1†† |
47,8†† |
62,4†† |
2,5 |
|
|
Glycémie à jeun (mmol/L) |
À l'inclusion (moyenne) |
9,00 |
9,04 |
8,91 |
9,13 |
|
Variation depuis l'inclusion |
-3,41## |
-3,77## |
-3,76## |
-2,16## |
|
|
Différence par rapport au placebo [IC 95 %] |
-1,25** [-1,64 ; -0,86] |
-1,61** [-2,00 ; -1,22] |
-1,60** [-1,99 ; -1,20] |
- |
|
|
Glycémie à jeun (mg/dL) |
À l'inclusion (moyenne) |
162,2 |
162,9 |
160,4 |
164,4 |
|
Variation depuis l'inclusion |
-61,4## |
-67,9## |
-67,7## |
-38,9## |
|
|
Différence par rapport au placebo [IC 95 %] |
-22,5** [-29,5 ; -15,4] |
-29,0** [-36,0 ; -22,0] |
-28,8** [-35,9 ; -21,6] |
- |
|
|
Poids corporel (kg) |
À l'inclusion (moyenne) |
95,5 |
95,4 |
96,2 |
94,1 |
|
Variation depuis l'inclusion |
-6,2## |
-8,2## |
-10,9## |
+1,7# |
|
|
Différence par rapport au placebo [IC 95 %] |
-7,8** [-9,4 ; -6,3] |
-9,9** [-11,5 ; -8,3] |
-12,6** [-14,2 ; -11,0] |
- |
|
|
Patients (%) atteignant une perte de poids |
≥ 5 % |
53,9†† |
64,6†† |
84,6†† |
5,9 |
|
≥ 10 % |
22,6†† |
46,9†† |
51,3†† | 0,9 |
|
|
≥ 15 % |
7,0† |
26,6† |
31,6†† | 0,0 |
|
†p < 0,05, †† p < 0,001 pour la comparaison au placebo, non ajusté pour tests multiples.
#p < 0,05, ## p < 0,001 pour la comparaison par rapport à l'inclusion, non ajusté pour tests multiples.
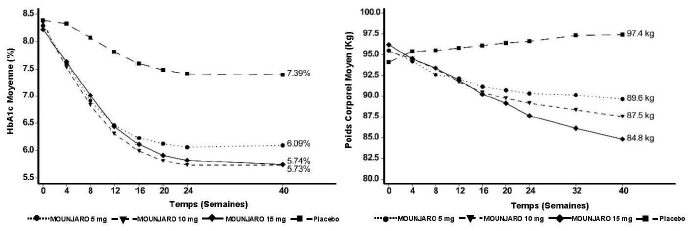
Figure 5. HbA1c moyenne (%) et poids corporel moyen (kg) de l'inclusion à la semaine 40
Contrôle du poids
L'efficacité et la sécurité du tirzépatide pour le contrôle du poids, en association avec un apport calorique réduit et une augmentation de l'activité physique, chez les patients en situation d'obésité (IMC ≥ 30 kg/m²), ou en surpoids (IMC ≥ 27 kg/m² et < 30 kg/m²) avec au moins une comorbidité liée au poids (comme une dyslipidémie, une hypertension artérielle, un syndrome d'apnées-hypopnées obstructives du sommeil, ou une maladie cardiovasculaire, traités ou non traités), et un prédiabète ou une normoglycémie, mais sans diabète de type 2, ont été évaluées dans trois études de phase 3 randomisées en double aveugle, contrôlées par placebo (SURMOUNT-1, SURMOUNT-3, SURMOUNT-4). Un total de 3 900 patients adultes (dont 2 518 randomisés dans le groupe tirzépatide) ont été inclus dans ces études.
Le traitement par tirzépatide a démontré une réduction du poids cliniquement significative et durable par rapport au placebo. De plus, un pourcentage plus élevé de patients ont atteint une perte de poids ≥ 5 %, ≥ 10 %, ≥ 15 % et ≥ 20 % avec le tirzépatide par rapport au placebo.
L'efficacité et la sécurité du tirzépatide pour le contrôle du poids chez les patients ayant un diabète de type 2 ont été évaluées dans une étude de phase 3 randomisée en double aveugle, contrôlée versus placebo (SURMOUNT-2), et dans une sous-population de patients ayant un IMC ≥ 27 kg/m² dans cinq études randomisées de phase 3 (SURPASS-1 à 5). Au total, 6 330 patients ayant un IMC ≥ 27 kg/m² (4 249 randomisés pour recevoir le tirzépatide) ont été inclus dans ces études. Dans l'étude SURMOUNT-2, le traitement par tirzépatide a démontré une réduction du poids cliniquement significative et durable par rapport au placebo. De plus, un pourcentage plus élevé de patients ont atteint une perte de poids ≥ 5 %, ≥ 10 %, ≥ 15 % et ≥ 20 % avec le tirzépatide par rapport au placebo. Les analyses de sous-groupes de patients en situation d'obésité ou en surpoids dans les études SURPASS (représentant 86 % de la population globale des études SURPASS-1 à 5) ont montré une réduction du poids durable, et un pourcentage plus élevé de patients atteignant les objectifs de réduction du poids par rapport aux patients recevant le comparateur actif/placebo.
Dans toutes les études SURMOUNT, le même schéma d'escalade de dose de tirzépatide que dans le programme SURPASS a été utilisé (en commençant par 2,5 mg pendant 4 semaines, suivi d'augmentations par paliers de 2,5 mg toutes les 4 semaines jusqu'à ce que la dose assignée soit atteinte).
SURMOUNT-1
Dans une étude contrôlée versus placebo en double aveugle d'une durée de 72 semaines, 2 539 patients adultes en situation d'obésité (IMC ≥ 30 kg/m²), ou en surpoids (IMC ≥ 27 kg/m² et < 30 kg/m²) avec au moins une comorbidité liée au poids, ont été randomisés pour recevoir du tirzépatide 5 mg, 10 mg ou 15 mg une fois par semaine ou un placebo. Tous les patients ont été conseillés sur un régime hypocalorique et une augmentation de leur activité physique tout au long de l'essai. À l'inclusion, l'âge moyen des patients était de 45 ans, 67,5 % étaient des femmes, et 40,6 % des patients avaient un prédiabète. L'IMC moyen à l'inclusion était de 38 kg/m².
Tableau 7. SURMOUNT-1 : Résultats à la semaine 72
|
|
Tirzépatide 5 mg |
Tirzépatide 10 mg |
Tirzépatide 15 mg |
Placebo |
|
Population mITT (n) |
630 |
636 |
630 |
643 |
|
Poids corporel |
|
|
|
|
|
À l'inclusion (kg) |
102,9 |
105,9 |
105,5 |
104,8 |
|
Variation (%) depuis l'inclusion |
-16,0†† |
-21,4†† |
-22,5†† |
-2,4 |
|
Différence (%) par rapport au placebo [IC 95 %] |
-13,5** [-14,6 ; -12,5] |
-18.9** [-20,0 ; -17,8] |
-20.1** [-21,2 ; -19,0] |
- |
|
Variation (kg) depuis l'inclusion |
-16,1†† |
-22,2†† |
-23,6†† |
-2,4†† |
|
Différence (kg) par rapport au placebo [IC 95 %] |
-13,8## [-15,0 ; -12,6] |
-19,8## [-21,0 ; -18,6] |
-21,2## [-22,4 ; -20,0] |
- |
|
Patients (%) atteignant une perte de poids corporel |
|
|
|
|
|
≥ 5 % |
89,4** |
96,2** |
96,3** |
27,9 |
|
≥ 10 % |
73,4## |
85,9** |
90,1** |
13,5 |
|
≥ 15 % |
50,2## |
73,6** |
78,2** |
6,0 |
|
≥ 20 % |
31,6## |
55,5** |
62,9** |
1,3 |
|
Tour de taille (cm) |
|
|
|
|
|
À l'inclusion |
113,2 |
114,9 |
114,4 |
114,0 |
|
Variation depuis l'inclusion |
-14,6†† |
-19,4†† |
-19,9†† |
-3,4†† |
|
Différence par rapport au placebo [IC 95 %] |
-11,2## [-12,3 ; -10,0] |
-16,0** [-17,2 ; -14,9] |
-16,5** [-17,7 ; -15,4] |
- |
**p < 0,001 pour la comparaison au placebo, ajusté pour tests multiples.
##p < 0,001 pour la comparaison au placebo, non ajusté pour tests multiples.
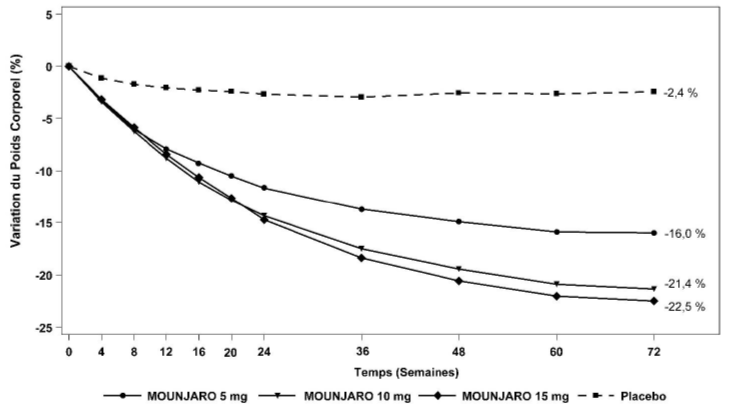
Figure 6. Variation moyenne du poids corporel (%) de l'inclusion à la semaine 72
Dans l'étude SURMOUNT-1, les doses combinées de tirzépatide 5 mg, 10 mg et 15 mg ont entraîné une amélioration significative par rapport au placebo de la pression artérielle systolique (-8,1 mmHg contre -1,3 mmHg), des triglycérides (-27,6 % contre -6,3 %), du cholestérol non-HDL (-11,3 % contre -1,8 %), du cholestérol HDL (7,9 % contre 0,3 %) et de l'insuline à jeun (-46,9 % contre - 9,7 %).
Parmi les patients de l'étude SURMOUNT-1 ayant un prédiabète à l'inclusion (N = 1 032), 95,3 % des patients traités par tirzépatide sont revenus à la normoglycémie à la semaine 72, contre 61,9 % des patients du groupe placebo.
SURMOUNT-2
Dans une étude contrôlée versus placebo en double aveugle d'une durée de 72 semaines, 938 patients adultes en situation d'obésité (IMC ≥ 30 kg/m2) ou en surpoids (IMC ≥ 27 kg/m2 et < 30 m2), et avec un diabète de type 2, ont été randomisés pour recevoir 10 mg ou 15 mg de tirzépatide une fois par semaine ou un placebo. Les patients inclus dans l'essai avaient un taux d'HbA1c compris entre 7 et 10 % et étaient traités par un régime alimentaire et une activité physique seulement, ou avec un ou plusieurs traitements oraux antihyperglycémiants. Tous les patients ont été conseillés sur un régime hypocalorique et une augmentation de leur activité physique tout au long de l'essai. Les patients avaient un âge moyen de 54 ans et 51 % étaient des femmes. L'IMC moyen à l'inclusion était de 36,1 kg/m2.
Tableau 8. SURMOUNT-2 : Résultats à la semaine 72
|
|
Tirzépatide 10 mg |
Tirzépatide 15 mg |
Placebo |
|
Population mITT (n) |
312 |
311 |
315 |
|
Poids corporel |
|
|
|
|
À l'inclusion (kg) |
101,1 |
99,5 |
101,7 |
|
Variation (%) depuis l'inclusion |
-13,4†† |
-15,7†† |
-3,3†† |
|
Différence (%) par rapport au placebo [IC 95 %] |
-10,1** [-11,5 ; -8,8] |
-12,4** [-13,7 ; -11,0] |
- |
|
Variation (kg) depuis l'inclusion |
-13,5†† |
-15,6†† |
-3,2 |
|
Différence (kg) par rapport au placebo [IC 95 %] |
-10,3## [-11,7 ; -8,8] |
-12,4## [-13,8 ; -11,0] |
- |
|
Patients (%) atteignant une perte de poids corporel |
|
|
|
|
≥ 5 % |
81,6** |
86,4** |
30,5 |
|
≥ 10 % |
63,4** |
69,6** |
8,7 |
|
≥ 15 % |
41,4** |
51,8** |
2,6 |
|
≥ 20 % |
23,0** |
34,0** |
1,0 |
|
Tour de taille (cm) |
|
|
|
|
À l'inclusion |
114,3 |
114,6 |
116,1 |
|
Variation depuis l'inclusion |
-11,2†† |
-13,8†† |
-3,4†† |
|
Différence par rapport au placebo [IC 95 %] |
-7,8** [-9,2 ; -6,4] |
-10,4** [-11,8 ; -8,9] |
- |
|
HbA1c (mmol/mol) |
|
|
|
|
À l'inclusion |
64,1 |
64,7 |
63,4 |
|
Variation depuis l'inclusion |
-23,4†† |
-24,3†† |
-1,8† |
|
Différence par rapport au placebo [IC 95 %] |
-21,6** [-23,5 ; -19,6] |
-22,5** [-24,4 ; -20,6] |
- |
|
HbA1c (%) |
|
|
|
|
À l'inclusion |
8,0 |
8,1 |
8,0 |
|
Variation depuis l'inclusion |
-2,1†† |
-2,2†† |
-0,2† |
|
Différence par rapport au placebo [IC 95 %] |
-2,0** [-2,2 ; -1,8] |
-2,1** [-2,2 ; -1,9] |
- |
|
Patients (%) atteignant une HbA1c |
|
|
|
|
< 7 % |
90,0** |
90,7** |
29,3 |
|
≤ 6,5 % |
84,1** |
86,7** |
15,5 |
|
< 5,7 % |
50,2** |
55,3** |
2,8 |
|
Glycémie à jeun (mmol/L) |
|
|
|
|
À l'inclusion |
8,8 |
9,0 |
8,7 |
|
Variation depuis l'inclusion |
-2,7†† |
-2,9†† |
-0,1 |
|
Différence par rapport au placebo [IC 95 %] |
-2,6** [-2,9 ; -2,3] |
-2,7** [-3,1 ; -2,4] |
- |
|
Glycémie à jeun (mg/dL) |
|
|
|
|
À l'inclusion |
157,8 |
161,5 |
156,7 |
|
Variation depuis l'inclusion |
-49,2†† |
-51,7†† |
-2,4 |
|
Différence par rapport au placebo [IC 95 %] |
-46,8** [-52,7 ; -40,9] |
-49,3** [-55,2 ; -43,3] |
- |
††p < 0,001 pour la comparaison par rapport à l'inclusion.
**p < 0,001 pour la comparaison au placebo, ajusté pour tests multiples.
##p < 0,001 pour la comparaison au placebo, non ajusté pour tests multiples.
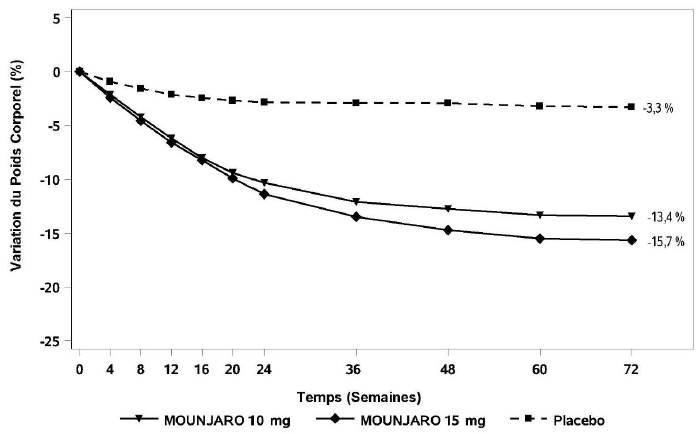
Figure 7. Variation moyenne du poids corporel (%) de l'inclusion à la semaine 72
Dans l'étude SURMOUNT 2, les doses combinées de tirzépatide 10 mg et 15 mg ont entraîné une amélioration significative par rapport au placebo de la pression artérielle systolique (-7,2 mmHg contre -1,0 mmHg), des triglycérides (-28,6 % contre -5,8 %), du cholestérol non-HDL (-6,6 % contre 2,3 %) et du cholestérol HDL (8,2 % contre 1,1 %).
SURMOUNT-3
Dans une étude de 84 semaines, 806 patients adultes en situation d'obésité (IMC ≥ 30 kg/m2) ou en surpoids (IMC ≥ 27 kg/m2 et < 30 kg/m2) et avec au moins une comorbidité liée au poids ont participé pendant une phase initiale de 12 semaines à un programme intensif de modifications thérapeutiques du mode de vie consistant en un régime hypocalorique (1 200 à 1 500 kcal/jour), une augmentation de l'activité physique et des conseils comportementaux fréquents. À la fin de la phase initiale de 12 semaines, 579 patients ayant atteint une perte de poids ≥ 5,0 % ont été randomisés pour recevoir une dose maximale tolérée (DMT) de tirzépatide de 10 mg ou 15 mg une fois par semaine ou un placebo, pendant 72 semaines (phase en double aveugle). Les patients suivaient un régime hypocalorique avec une augmentation de leur activité physique tout au long de la phase en double aveugle de l'étude. Lors de la randomisation, les patients avaient un âge moyen de 46 ans et 63 % étaient des femmes. L'IMC moyen lors de la randomisation était de 35,9 kg/m2.
Tableau 9. SURMOUNT-3 : Résultats à la semaine 72
|
|
Tirzépatide DMT |
Placebo |
|
Population mITT (n) |
287 |
292 |
|
Poids corporel |
||
|
À l'inclusion1 (kg) |
102,3 |
101,3 |
|
Variation (%) depuis l'inclusion1 |
-21,1†† |
3,3†† |
|
Différence (%) par rapport au placebo [IC 95 %] |
-24,5** [-26,1 ; -22,8] |
- |
|
Variation (kg) depuis l'inclusion1 |
-21,5†† |
3,5†† |
|
Différence (kg) par rapport au placebo [IC 95 %] |
-25,0## [-26,9 ; -23,2] |
- |
|
Patients (%) atteignant une perte de poids corporel |
||
|
≥ 5 % |
94,4** |
10,7 |
|
≥ 10 % |
88,0** |
4,8 |
|
≥ 15 % |
73,9** |
2,1 |
|
≥ 20 % |
54,9** |
1,0 |
|
Patients (%) ayant maintenu au moins 80 % de la perte de
poids corporel obtenue durant la phase initiale de 12 semaines |
98,6** |
37,8 |
|
Tour de taille (cm) |
||
|
À l'inclusion1 |
109,2 |
109,6 |
|
Variation depuis l'inclusion1 |
-16,8†† |
1,1 |
|
Différence par rapport au placebo [IC 95 %] |
-17,9** [-19,5 ; -16,3] |
- |
††p < 0,001 pour la comparaison par rapport à l'inclusion1.
**p < 0,001 pour la comparaison au placebo, ajusté pour tests multiples.
##p < 0,001 pour la comparaison au placebo, non ajusté pour tests multiples.
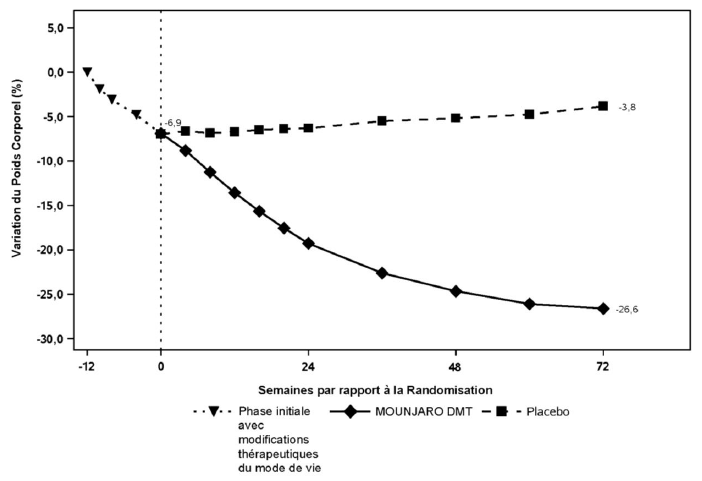
Figure 8. Variation moyenne du poids corporel (%) de la semaine -12 à la semaine 72
SURMOUNT-4
Dans une étude de 88 semaines, 783 patients adultes en situation d'obésité (IMC ≥ 30 kg/m2) ou en surpoids (IMC ≥ 27 kg/m2 et < 30 kg/m2) et avec au moins une comorbidité liée au poids ont été inclus dans une phase initiale en ouvert de 36 semaines durant laquelle ils ont reçu du tirzépatide. Au début de la phase initiale, les patients inclus avaient un poids corporel moyen de 107,0 kg et un IMC moyen de 38,3 kg/m2. À la fin de la phase initiale, 670 patients ayant atteint une DMT de tirzépatide de 10 mg ou 15 mg ont été randomisés pour poursuivre le traitement par tirzépatide une fois par semaine ou pour passer au placebo pendant 52 semaines (phase en double aveugle). Les patients ont été conseillés sur un régime hypocalorique et une augmentation de leur activité physique tout au long de l'essai. Lors de la randomisation (semaine 36), les patients avaient un âge moyen de 49 ans et 71 % étaient des femmes. Le poids corporel moyen lors de la randomisation était de 85,2 kg et l'IMC moyen était de 30,5 kg/m2.
Les patients qui ont continué le traitement par tirzépatide pendant 52 semaines supplémentaires (jusqu'à 88 semaines au total) ont maintenu et présenté une perte de poids supplémentaire après la perte de poids initiale obtenue au cours de la phase initiale de 36 semaines. La perte de poids était supérieure et cliniquement significative par rapport au groupe placebo, dans lequel une reprise substantielle du poids corporel perdu au cours de la phase initiale a été observée (voir Tableau 10 et Figure 9). Néanmoins, le poids corporel moyen observé chez les patients traités par placebo était inférieur à la semaine 88 par rapport au début de la phase initiale (voir Figure 9).
Tableau 10. SURMOUNT-4 : Résultats à la semaine 88
|
|
Tirzépatide DMT |
Placebo |
|
Population mITT (n) - seulement les patients à la semaine 36 |
335 |
335 |
|
Poids corporel |
||
|
Poids (kg) à la semaine 0 (inclusion) |
106,7 |
107,8 |
|
Poids (kg) à la semaine 36 (randomisation) |
84,5 |
85,9 |
|
Variation (%) de la semaine 36 à la semaine 88 |
-6,7†† |
14,8†† |
|
Différence (%) par rapport placebo à la semaine 88 [IC 95 %] |
-21,4** [-22,9 ; -20,0] |
- |
|
Variation (kg) de la semaine 36 à la semaine 88 |
-5,7†† |
11,9†† |
|
Différence (kg) par rapport au placeboà la
semaine 88 [IC 95 %] |
-17,6## [-18,8 ; -16,4] |
- |
|
Patients (%) atteignant une perte de poids corporel de la semaine 0 à la semaine 88 |
||
|
≥ 5 % |
98,5** |
69,0 |
|
≥ 10 % |
94,0** |
44,4 |
|
≥ 15 % |
87,1** |
24,0 |
|
≥ 20 % |
72,6** |
11,6 |
|
Patients (%) ayant maintenu à la semaine 88 au moins 80
% de la perte de poids corporel obtenue durant la phase initiale de 36 semaines |
93,4** |
13,5 |
|
Tour de taille (cm) |
||
|
À l'inclusion (semaine 0) |
114,9 |
115,6 |
|
À la randomisation (semaine 36) |
96,7 |
98,2 |
|
Variation depuis la randomisation (semaine 36) |
-4,6†† |
8,3†† |
|
Différence par rapport au placebo [IC 95 %] |
-12,9** [-14,1 ; -11,7] |
- |
**p < 0,001 pour la comparaison au placebo, ajusté pour tests multiples.
##p < 0,001 pour la comparaison au placebo, non ajusté pour tests multiples.
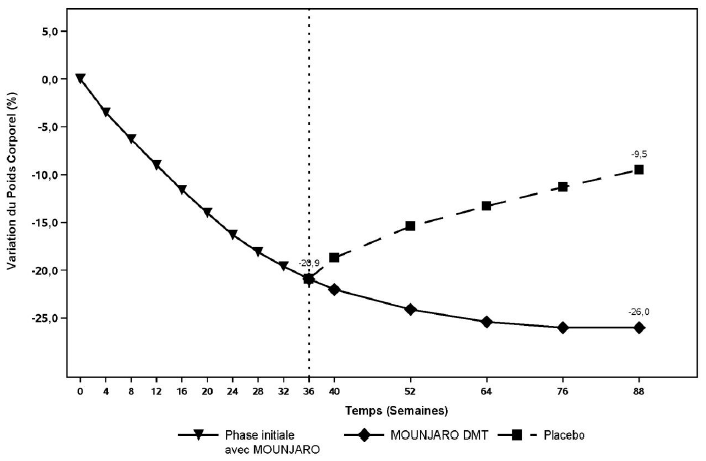
Figure 9. Variation moyenne du poids corporel (%) de l'inclusion (semaine 0) à la semaine 88
Risque
de reprise de poids > 95 % du poids à l'inclusion (semaine 0) à la semaine
88
L'analyse du temps écoulé jusqu'à l'événement a montré
que chez les sujets ayant perdu au moins 5 % de leur poids observé à la semaine
0, la poursuite du traitement par tirzépatide pendant la période en double
aveugle réduisait le risque de retour à un poids ≥ 95 % du poids observé à la
semaine 0 d'environ 99 % par rapport au placebo (rapport de risque, 0,013 [IC à
95 %, 0,004 à 0,046] ; p < 0,001).
Effet sur la composition corporelle
Les variations dans la composition corporelle ont été évaluées dans une sous-étude de SURMOUNT-1 en utilisant l'absorptiométrie biphotonique à rayons X (DEXA). Les résultats de l'évaluation par DEXA ont montré que le traitement par tirzépatide s'accompagnait d'une réduction plus importante de la masse grasse que de la masse maigre, conduisant à une amélioration de la composition corporelle par rapport au placebo après 72 semaines. De plus, cette réduction de masse grasse totale s'accompagnait d'une réduction de la graisse viscérale. Ces résultats suggèrent que la majeure partie de la perte de poids totale était attribuable à une réduction du tissu adipeux, notamment de la graisse viscérale.
Amélioration du fonctionnement physique
Les patients en situation d'obésité ou en surpoids sans diabète qui ont reçu du tirzépatide ont présenté de légères améliorations de leur qualité de vie liée à la santé, y compris le fonctionnement physique. Les améliorations ont été plus importantes chez les patients traités par tirzépatide par rapport à ceux ayant reçu le placebo. La qualité de vie liée à la santé a été évaluée à l'aide du questionnaire générique Short Form-36v2 Health Survey Acute, Version(SF-36v2).
Syndrome d'apnées-hypopnées obstructives du sommeil
L'efficacité et la sécurité du tirzépatide dans le traitement du syndrome d'apnées-hypopnées obstructives du sommeil (SAHOS) modéré à sévère (IAH > 15), en complément d'un régime alimentaire et d'une activité physique, chez les patients en situation d'obésité ont été évaluées dans deux études de phase 3 randomisées en double aveugle et contrôlées versus placebo (SURMOUNTOSA Étude 1 et Étude 2). Au total, 469 patients adultes en situation d'obésité et présentant un SAHOS modéré à sévère (234 randomisés pour recevoir un traitement par tirzépatide) ont été inclus dans ces études. Les patients ayant un diabète de type 2 ont été exclus. L'étude 1 a inclus des patients ne souhaitant pas ou ne pouvant pas avoir recours à un traitement par Pression Positive Continue (PPC). L'étude 2 a inclus des patients sous traitement par PPC. L'étude 2 ne permet pas de conclure à un bénéfice supplémentaire potentiel du tirzépatide en plus du traitement par PPC, puisque l'utilisation de la PPC a été suspendue 7 jours avant la mesure du critère d'évaluation. Tous les patients ont été traités avec la dose maximale tolérée (DMT : 10 mg ou 15 mg) de tirzépatide ou un placebo, une fois par semaine pendant 52 semaines.
Une réduction statistiquement significative et cliniquement pertinente de l'indice d'apnée-hypopnée (IAH) par rapport au placebo (voir Tableau 11) a été mise en évidence dans les 2 études. Parmi les patients traités par tirzépatide, une plus grande proportion a obtenu une réduction d'au moins 50 % de l'IAH par rapport au placebo.
SURMOUNT-OSA, Étude 1 et Étude 2
Dans deux études contrôlées versus placebo en double aveugle de 52 semaines, 469 patients adultes en situation d'obésité et présentant un SAHOS modéré à sévère ont été randomisés pour recevoir une DMT de tirzépatide de 10 mg ou 15 mg une fois par semaine, ou un placebo une fois par semaine. Dans l'étude 1, les patients avaient un âge moyen de 48 ans, 33 % étaient des femmes, 35 % avaient un SAHOS modéré, 63 % avaient un SAHOS sévère, 65 % avaient un prédiabète, 76 % avaient une hypertension artérielle, 10 % avaient des troubles cardiaques et 81 % avaient une dyslipidémie. Les patients avaient une échelle de somnolence d'Epworth (Epworth Sleepiness Scale, ESS) moyenne de 10,5. Dans l'étude 2, les patients avaient un âge moyen de 52 ans, 28 % étaient des femmes, 31 % avaient un SAHOS modéré, 68 % avaient un SAHOS sévère, 57 % avaient un prédiabète, 77 % avaient une hypertension artérielle, 11 % avaient des troubles cardiaques et 84 % avaient une dyslipidémie. Les patients avaient une ESS moyenne de 10,0.
Tableau 11. SURMOUNT-OSA, Étude 1 et Étude 2 : Résultats à la semaine 52
|
|
SURMOUNT-OSA Étude 1 |
SURMOUNT-OSA Étude 2 |
||
|
|
Tirzépatide DMT |
Placebo |
Tirzépatide DMT |
Placebo |
|
Population mITT (n) |
114 |
120 |
119 |
114 |
|
IAH (évènements/h) |
||||
|
Moyenne à l'inclusion |
54,3 |
50,9 |
45,8 |
53,1 |
|
Variation depuis l'inclusion |
-27,4†† |
-4,8† |
-30,4†† |
-6,0† |
|
Différence par rapport au placebo [IC 95 %] |
-22,5** [-28,7 ; -16,4] |
- |
-24,4** [-30,3 ; -18,6] |
- |
|
Variation (%) de l'IAH |
||||
|
Variation (%) depuis l'inclusion |
-55,0†† |
-5,0 |
-62,8†† |
-6,4 |
|
Différence (%) par rapport au placebo [IC 95 %] |
-49,9** [-62,8 ; -37,0] |
- |
-56,4** [-70,7 ; -42,2] |
- |
|
Patients (%) atteignant une réduction de l'IAH |
||||
|
≥ 50 % |
62,3 |
19,2 |
74,3 |
22,9 |
|
Différence
(%) par rapport au placebo [IC 95%] |
43,6** [31,1 ; 56,2] |
- |
50,8** [38,6 ; 62,9] |
- |
|
Charge hypoxique spécifique à l'apnée du sommeil (% min/h)a |
||||
|
Moyenne géométrique à l'inclusion |
156,6 |
148,2 |
129,9 |
139,1 |
|
Variation depuis l'inclusion |
-103,1†† |
-21,1 |
-103,0†† |
-40,7† |
|
Différence par rapport au placebo [IC 95 %] |
-82,0** [-107,0 ; -57,1] |
- |
-62,4** [-87,1 ; -37,6] |
- |
|
Poids corporel (kg) |
|
|
||
|
Moyenne à l'inclusion |
117,0 |
112,7 |
115,8 |
115,0 |
|
Variation (%) depuis l'inclusion |
-18,1†† |
-1,3 |
-20,1†† |
-2,3† |
|
Différence (%) par rapport au placebo [IC 95 %] |
-16,8** [-18,8 ; -14,7] |
- |
-17,8** [-19,9 ; -15,7] |
- |
|
Pression artérielle systolique (mmHg)b |
|
|
||
|
Moyenne à l'inclusion |
128,2 |
130,3 |
130,7 |
130,5 |
|
Variation depuis l'inclusion |
-9,6†† |
-1,7 |
-7,6†† |
-3,3† |
|
Différence
par rapport au placebo [IC 95 %] |
-7,9** [-11,0 ; -4,9] |
- |
-4,3* [-7,3 ; -1,2] |
- |
|
hsCRP (mg/L)a |
|
|||
|
Moyenne géométrique à l'inclusion |
3,6 |
3,8 |
3,0 |
2,7 |
|
Variation depuis l'inclusion |
-1,6†† |
-0,8† |
-1,4†† |
-0,3 |
|
Différence
par rapport au placebo [IC 95 %] |
-0,8* [-1,4 ; -0,3] |
- |
-1,1** [-1,7 ; -0,5] |
- |
* p < 0,05 ; **p < 0,001 pour la comparaison au placebo, ajusté pour tests multiples.
a Analysé à l'aide de données transformées par logarithme.
b La pression artérielle a été évaluée à la semaine 48 car l'arrêt du traitement par PPC à la semaine 52 peut perturber l'évaluation de la pression artérielle.
Evaluation cardiovasculaire
Le risque cardiovasculaire (CV) a été évalué dans une méta-analyse de patients ayant présenté au moins un événement indésirable cardiovasculaire majeur (major adverse cardiovascular event, MACE) confirmé par un comité d'adjudication. Le critère composite MACE-4 comprenait décès de causes CV, infarctus du myocarde non fatal, accident vasculaire cérébral non fatal ou hospitalisation pour angor instable.
Dans une méta-analyse primaire des études d'enregistrement de phases 2 et 3 chez des patients ayant un diabète de type 2, 116 patients au total (tirzépatide : 60 [n = 4 410] ; tous comparateurs confondus : 56 [n = 2 169]) ont présenté au moins un MACE-4 confirmé par adjudication : les résultats ont montré que le tirzépatide n'était pas associé à un surrisque d'événements CV par rapport aux comparateurs regroupés (HR : 0,81 ; IC : 0,52 à 1,26).
Une analyse supplémentaire a été menée spécifiquement pour l'étude SURPASS-4 qui a inclus des patients présentant une maladie CV établie. 109 patients au total (tirzépatide : 47 [n = 995] ; insuline glargine : 62 [n = 1 000]) ont présenté au moins un MACE-4 confirmé par adjudication : les résultats ont montré que le tirzépatide n'était pas associé à un surrisque d'événements CV par rapport à l'insuline glargine (HR : 0,74 ; IC : 0,51 à 1,08).
Dans 3 études de phase 3 contrôlées versus placebo dédiées au contrôle du poids (SURMOUNT- 1 à 3), un total de 27 participants ont présenté au moins un MACE confirmé par adjudication (tirzépatide : 17 [n = 2 806] ; placebo : 10 [n = 1 250]) ; le taux d'événements était similaire entre le placebo et le tirzépatide.
Pression
artérielle
Dans les études de phase 3 contrôlées versus placebo
chez des patients ayant un DT2, le traitement par tirzépatide a entraîné une
diminution moyenne de la pression artérielle systolique et diastolique de
respectivement 6 à 9 mmHg et 3 à 4 mmHg. Les patients sous placebo ont présenté
une diminution moyenne de la pression artérielle systolique et diastolique de 2
mmHg.
Dans 3 études de phase 3 contrôlées versus placebo dédiées au contrôlé du poids (SURMOUNT1 à 3), le traitement par tirzépatide a entraîné une diminution moyenne de la pression artérielle systolique et diastolique de respectivement 7 mmHg et 4 mmHg. Les patients sous placebo ont présenté une diminution moyenne de la pression artérielle systolique et diastolique < 1 mmHg.
Dans deux études de phase 3 contrôlées versus placebo dédiées au SAHOS et comportant une analyse groupée des données de sécurité, le traitement par tirzépatide a entraîné une diminution moyenne de la pression artérielle systolique et diastolique de respectivement 9,0 mmHg et 3,8 mmHg à la semaine 52. Les patients sous placebo ont présenté une diminution moyenne de la pression artérielle systolique et diastolique de respectivement 2,5 mmHg et 1,0 mmHg à la semaine 52.
Autres informations
Glycémie à jeun
Dans les essais SURPASS-1 à 5, le traitement par tirzépatide a entraîné des réductions significatives de la glycémie à jeun par rapport à l'inclusion (variations entre l'inclusion et la fin de la période d'évaluation principale de -2,4 mmol/L à -3,8 mmol/L). Des réductions significatives de la glycémie à jeun par rapport à l'inclusion ont pu être observées dès 2 semaines. Une amélioration supplémentaire de la glycémie à jeun a été observée jusqu'à 42 semaines, puis s'est maintenue jusqu'à la fin de l'étude la plus longue, à savoir 104 semaines.
Glycémie post-prandiale
Dans les essais SURPASS-1 à 5, le traitement par tirzépatide a entraîné des réductions significatives de la glycémie post-prandiale moyenne sur 2 heures (moyenne des 3 principaux repas de la journée) par rapport à l'inclusion (variations entre l'inclusion et la fin de la période d'évaluation principale de -3,35 mmol/L à -4,85 mmol/L).
Triglycérides
Dans les essais SURPASS-1 à 5, le tirzépatide 5 mg, 10 mg et 15 mg a entraîné une réduction des triglycérides sériques de respectivement 15-19 %, 18-27 % et 21-25 %.
Dans l'essai d'une durée de 40 semaines versus sémaglutide 1 mg, le tirzépatide 5 mg, 10 mg et 15 mg a entraîné une réduction de respectivement 19 %, 24 % et 25 % des taux de triglycérides sériques contre une réduction de 12 % avec le sémaglutide 1 mg.
Dans l'étude de phase 3 contrôlée versus placebo de 72 semaines chez des patients en situation d'obésité ou en surpoids sans DT2 (SURMOUNT-1), le traitement par tirzépatide 5 mg, 10 mg et 15 mg a entraîné une réduction de respectivement 24 %, 27 % et 31 % des taux sériques de triglycérides contre une réduction de 6 % avec le placebo.
Dans l'étude de phase 3 contrôlée versus placebo de 72 semaines chez des patients en situation d'obésité ou en surpoids avec DT2 (SURMOUNT-2), le traitement par tirzépatide 10 mg et 15 mg a entraîné une réduction de respectivement 27 % et 31 % des taux sériques de triglycérides contre une réduction de 6 % avec le placebo.
Proportion de patients ayant atteint une HbA1c < 5,7 % sans hypoglycémie cliniquement significative
Dans les 4 études où le tirzépatide n'était pas associé à l'insuline basale (SURPASS-1 à 4), 93,6 % à 100 % des patients traités par tirzépatide ayant atteint une glycémie normale équivalente à un taux d'HbA1c < 5,7 % (≤ 39 mmol/mol) à la visite du critère principal n'ont pas présenté hypoglycémie cliniquement significative. Dans l'étude SURPASS-5, 85,9 % des patients traités par tirzépatide ayant atteint un taux d'HbA1c < 5,7 % (≤ 39 mmol/mol) y sont parvenus sans hypoglycémie cliniquement significative.
Populations spéciales
L'efficacité du tirzépatide dans le traitement du DT2 n'a pas été affectée par l'âge, le sexe, la race, l'origine ethnique et géographique, ni par l'IMC, l'HbA1c, la durée du diabète et le niveau d'altération de la fonction rénale à l'inclusion.
L'efficacité du tirzépatide pour le contrôle du poids n'a pas été affectée par l'âge, le sexe, la race, l'origine ethnique et géographique, l'IMC et la présence ou l'absence d'un prédiabète à l'inclusion.
L'efficacité du tirzépatide dans le traitement du SAHOS modéré à sévère chez les patients en situation d'obésité n'a pas été affectée par l'âge, le sexe, l'origine ethnique, l'IMC à l'inclusion ou la sévérité du SAHOS à l'inclusion.
Population pédiatrique
L'Agence européenne des médicaments a différé l'obligation de soumettre les résultats d'études réalisées avec Mounjaro dans un ou plusieurs sous-groupes de la population pédiatrique pour le traitement du diabète de type 2 et pour le contrôle du poids (voir rubrique Posologie et mode d'administration pour les informations concernant l'usage pédiatrique).
Le tirzépatide se compose de 39 acides aminés et est doté d'un fragment diacide gras en C20 qui lui permet de se lier à l'albumine et de prolonger la demi-vie.
Absorption
La concentration maximale de tirzépatide est atteinte
8 à 72 heures après administration d'une dose.
L'exposition à l'état d'équilibre est atteinte après 4
semaines en administration hebdomadaire. L'exposition au tirzépatide augmente
de manière proportionnelle à la dose.
Une exposition similaire a été obtenue avec une administration sous-cutanée de tirzépatide dans l'abdomen, la cuisse ou le haut du bras.
La biodisponibilité absolue du tirzépatide par voie sous-cutanée était de 80 %.
Distribution
Le volume de distribution apparent moyen à l'état d'équilibre du tirzépatide après administration souscutanée chez les patients ayant un diabète de type 2 est d'environ 10,3 L, et 9,7 L chez les patients en situation d'obésité.
Le tirzépatide est fortement lié à l'albumine plasmatique (99 %).
Biotransformation
Le tirzépatide est métabolisé par clivage protéolytique de la chaîne peptidique, bêta-oxydation du fragment diacide gras en C20 et hydrolyse des amides.
Élimination
La clairance apparente moyenne du tirzépatide dans la population est d'environ 0,06 L/h avec une demi-vie d'élimination d'environ 5 jours, ce qui permet de l'administrer une fois par semaine.
Le tirzépatide est éliminé par métabolisme. Les principales voies d'excrétion des métabolites du tirzépatide sont l'urine et les fèces. Le tirzépatide intact n'a été détecté ni dans les urines ni dans les fèces.
Populations spéciales
Âge, sexe, race, origine ethnique, poids corporel
L'âge, le sexe, la race, l'origine ethnique ou le poids corporel n'ont aucun effet cliniquement pertinent sur la pharmacocinétique (PK) du tirzépatide. D'après une analyse pharmacocinétique de population, l'exposition au tirzépatide augmente avec la diminution du poids corporel ; cependant, le poids corporel ne semble pas présenter d'effet cliniquement pertinent sur la pharmacocinétique du tirzépatide.
Insuffisance rénale
L'insuffisance rénale n'a aucune incidence sur la
pharmacocinétique du tirzépatide.
La pharmacocinétique du tirzépatide après
administration d'une dose unique de 5 mg a été évaluée chez des patients
présentant divers degrés d'insuffisance rénale (légère, modérée, sévère, IRT)
en comparaison avec des sujets ayant une fonction rénale normale et aucune
différence cliniquement pertinente n'a été observée. Cela a également été
observé chez des patients présentant à la fois un diabète de type 2 et une
insuffisance rénale d'après des données d'études cliniques.
Insuffisance hépatique
L'insuffisance hépatique n'a aucune incidence sur la
pharmacocinétique du tirzépatide.
La pharmacocinétique du tirzépatide après
administration d'une dose unique de 5 mg a été évaluée chez des patients
présentant divers degrés d'insuffisance hépatique (légère, modérée, sévère) en
comparaison avec des sujets ayant une fonction hépatique normale et aucune
différence cliniquement pertinente n'a été observée.
Population pédiatrique
Le tirzépatide n'a pas été étudié chez les patients pédiatriques.
Le tirzépatide n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines. Les patients doivent être informés des précautions à prendre pour éviter une hypoglycémie lors de la conduite de véhicules ou de l'utilisation de machines lorsque le tirzépatide est utilisé en association avec un sulfamide hypoglycémiant ou de l'insuline (voir rubrique Mises en garde spéciales et précautions d'emploi).
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée ou génotoxicité n'ont pas révélé de risque particulier pour l'homme.
Une étude de carcinogénicité sur 2 ans a été menée avec le tirzépatide chez des rats mâles et femelles à des doses de 0,15, 0,50 et 1,5 mg/kg (soit 0,12, 0,36 et 1,02 fois la dose maximale recommandée chez l'homme (DMRH), basée sur l'ASC) avec une administration par injection sous-cutanée deux fois par semaine. Le tirzépatide a provoqué une augmentation des tumeurs des cellules C de la thyroïde (adénomes et carcinomes) à toutes les doses par rapport aux témoins. La pertinence de ces résultats pour l'homme est inconnue.
Dans une étude de carcinogénicité de 6 mois chez des souris transgéniques rasH2, le tirzépatide à des doses de 1, 3 et 10 mg/kg administrées par injection sous-cutanée deux fois par semaine n'a entraîné aucune augmentation de l'incidence des hyperplasies des cellules C de la thyroïde ou des néoplasies, quelle que soit la dose administrée.
Les études chez l'animal avec le tirzépatide n'ont pas mis en évidence d'effets délétères directs sur la fertilité.
Dans les études de reproduction chez l'animal, le tirzépatide a provoqué des réductions de la croissance fœtale et des anomalies fœtales à des expositions inférieures à la DMRH, basée sur l'ASC. Une augmentation de l'incidence des malformations externes, viscérales et squelettiques et des variations du développement viscéral et squelettique ont été observées chez les rats. Des diminutions de la croissance fœtale ont été observées chez les rats et les lapins. Tous les effets sur le développement se sont produits à des doses toxiques pour la mère.
Instructions pour l'utilisation
Vérifier l'aspect de Mounjaro avant l'utilisation et
ne pas l'utiliser si la solution contient des particules ou en cas de
changement de couleur.
Mounjaro ne doit pas être utilisé s'il a été congelé.
Stylo
pré-rempli, unidose
Le stylo pré-rempli est à usage unique.
Suivre attentivement les instructions d'utilisation du stylo, jointes à la notice.
Flacon,
unidose
Le flacon est à usage unique.
Suivre attentivement les instructions de la notice sur
la façon d'injecter Mounjaro à partir d'un flacon.
Stylo
pré-rempli (KwikPen), multidose
Le stylo pré-rempli KwikPen contient plusieurs doses.
Chaque stylo KwikPen contient 4 doses. Eliminer le stylo après 4 doses
hebdomadaires.
Suivre attentivement les instructions d'utilisation du stylo KwikPen, jointes à la notice.
Élimination
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I.
- La prescription initiale de ces médicaments doit être réalisée par un médecin
spécialiste en endocrinologie-diabétologie-nutrition ou compétent en nutrition
(à savoir titulaire d’un DESC, d’une FST ou d’une VAE de nutrition) ;
- Les
renouvellements peuvent être réalisés par tout médecin.
Solution injectable (injection).
Solution limpide, incolore à légèrement jaune.
Stylo pré-rempli (KwikPen), multidose
Cartouche en verre transparent contenue dans un stylo pré-rempli multidose.
Chaque
stylo pré-rempli KwikPen contient 2,4 mL de solution injectable (4
doses de 0,6 mL). Chaque stylo possède un volume excédentaire pour la
purge. Cependant, toute tentative d'injection du médicament restant
entraînera une dose incomplète, même si le stylo contient encore du
médicament. Les aiguilles ne sont pas fournies.
Boîte de 1 stylo pré-rempli KwikPen.
Stylo pré-rempli (KwikPen), multidose
Mounjaro 5 mg/dose KwikPen solution injectable en stylo pré-rempli
Chaque
dose contient 5 mg de tirzépatide dans 0,6 mL de solution. Chaque stylo
pré-rempli multidose contient 20 mg de tirzépatide dans 2,4 mL (8,33
mg/mL). Chaque stylo délivre 4 doses de 5 mg.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Hydrogénophosphate disodique heptahydraté (E339)
Alcool benzylique (E1519)
Glycérol
Phénol
Chlorure de sodium
Acide chlorhydrique concentré (pour ajustement du pH)
Hydroxyde de sodium (pour ajustement du pH)
Eau pour préparations injectables
Alcool benzylique (E1519)
Glycérol
Phénol
Chlorure de sodium
Acide chlorhydrique concentré (pour ajustement du pH)
Hydroxyde de sodium (pour ajustement du pH)
Eau pour préparations injectables
Information médicale : www.lillymedical.fr
Afin de vous offrir la meilleure qualité de service, le Service Client
Lilly France met à votre disposition des ventes directes et un service
de dépannage d’urgence :
Tel : 01.55.49.33.21 - Email : paris_service_client@lilly.com - Demandes de dépannage | lillypharmacien.fr
Vous pouvez également passer votre demande de ventes directes et dépannage via le site internet https://www.vigirupture.fr/*24h/24h ,7j/7j avec confirmation par email de votre commande.
*Site internet indépendant de Lilly France administré par la société Offisanté
Posologie
La dose initiale de tirzépatide est de 2,5 mg une fois par semaine.
Après 4 semaines, la dose doit être augmentée à 5 mg une fois par
semaine. Si nécessaire, des augmentations de dose peuvent être
effectuées par paliers de 2,5 mg après un minimum de 4 semaines à la
dose en cours.
Les doses d’entretien recommandées sont de 5 mg, 10 mg et 15 mg.
KwikPen
Le stylo pré-rempli KwikPen contient plusieurs doses. Chaque stylo
KwikPen contient 4 doses. Eliminer le stylo après 4 doses hebdomadaires.
Chaque stylo possède un volume excédentaire pour la purge. Cependant,
toute tentative d’injection du médicament restant entraînera une dose
incomplète, même si le stylo contient encore du médicament.
Les aiguilles ne sont pas fournies.
Autres dosages commercialisés en France :
Mounjaro 2,5 mg/dose KwikPen solution injectable en stylo pré rempli (3400930292907)
Mounjaro 7,5 mg/dose KwikPen solution injectable en stylo pré rempli (3400930292938)
Mounjaro 10 mg/dose KwikPen solution injectable en stylo pré rempli (3400930292945)
Découvrez tous nos outils
Pour accompagner vos patients : Lilly en diabétologie | Lilly France
Outil Lilly d'évaluation des excursions de température : www.excursiontemperature.fr
