PREVENAR 20, suspension injectable en seringue préremplie. Vaccin pneumococcique polyosidique conjugué (20-valent, adsorbé), boîte de 1 seringue préremplie ( 1 aiguille) de ½ mL
Dernière révision : 24/04/2025
Taux de TVA : 2.1%
Prix de vente : 58,24 €
Taux remboursement SS : 65%
Base remboursement SS : 58,24 €
Laboratoire exploitant : PFIZER
Immunisation active pour la prévention des maladies invasives, des pneumonies et des otites moyennes aiguës causées par Streptococcus pneumoniae chez les nourrissons, les enfants et les adolescents âgés de 6 semaines à moins de 18 ans.
Immunisation active pour la prévention des maladies invasives et des pneumonies causées par Streptococcus pneumoniae chez les personnes âgées de 18 ans et plus.
Voir rubriques Mises en garde spéciales et précautions d'emploi et Propriétés pharmacodynamiques pour des informations sur la protection contre des sérotypes pneumococciques spécifiques.
Prevenar 20 doit être utilisé conformément aux recommandations officielles.
Hypersensibilité aux substances actives, à l'un des excipients mentionnés à la rubrique Liste des excipients, ou à l'anatoxine diphtérique.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Hypersensibilité
Comme pour tout vaccin injectable, un traitement et une surveillance médicale appropriés doivent toujours être disponibles en cas de réaction anaphylactique rare après l'administration du vaccin.
Maladie concomitante
La vaccination doit être reportée chez les personnes présentant une affection fébrile sévère aiguë. Toutefois, la présence d'une infection mineure, telle qu'un rhume, ne doit pas entraîner le report de la vaccination.
Thrombopénie et troubles de la coagulation
Le vaccin doit être administré avec prudence aux personnes souffrant de thrombopénie ou d'un trouble de la coagulation, car des saignements peuvent survenir après une administration intramusculaire.
Le risque de saignement chez les patients atteints de troubles de la coagulation doit être soigneusement évalué avant l'administration intramusculaire de tout vaccin, et l'administration sous-cutanée doit être envisagée si le bénéfice potentiel l'emporte clairement sur les risques.
Protection contre les infections pneumococciques
Prevenar 20 peut protéger uniquement contre les sérotypes de Streptococcus pneumoniae inclus dans le vaccin, et ne protège pas contre d'autres micro-organismes qui provoquent des maladies invasives, des pneumonies ou des otites moyennes aiguës (OMA). Comme tout vaccin, Prevenar 20 peut ne pas protéger toutes les personnes vaccinées contre les maladies pneumococciques invasives (MPI), les pneumonies ou OMA. Pour obtenir les informations épidémiologiques les plus récentes dans votre pays, vous devez consulter l'organisation nationale compétente.
Personnes immunodéprimées
Les données de sécurité et d'immunogénicité de Prevenar 20 ne sont pas disponibles pour les individus des groupes immunodéprimés. La vaccination doit être envisagée sur une base individuelle.
D'après l'expérience acquise avec les vaccins pneumococciques, certaines personnes présentant une immunocompétence altérée peuvent avoir des réponses immunitaires réduites à Prevenar 20.
Les personnes dont la réponse immunitaire est altérée, que ce soit en raison de l'utilisation d'un traitement immunosuppresseur, d'un défaut génétique, d'une infection par le VIH ou d'autres causes, peuvent avoir une réponse en anticorps réduite à l'immunisation active. La pertinence clinique de ce phénomène est inconnue.
Les données de sécurité et d'immunogénicité de Prevenar 13 (un vaccin pneumococcique conjugué composé de 13 conjugués polysaccharidiques également présents dans Prevenar 20) sont disponibles pour les personnes infectées par le VIH, atteintes de drépanocytose ou ayant subi une GCSH (voir rubriques Effets indésirables et Propriétés pharmacodynamiques). Prevenar 20 doit être utilisé conformément aux recommandations officielles.
Chez les adultes de tous les groupes d'âge étudiés, les critères formels de non-infériorité ont été respectés bien que des moyennes géométriques des titres (MGT) numériquement plus faibles aient été observées avec Prevenar 20 pour la plupart des sérotypes par rapport à Prevenar 13 (voir rubrique Propriétés pharmacodynamiques). Chez les enfants, des moyennes géométriques des concentrations (MGC) d'immunoglobulines G (IgG) numériquement plus faibles ont été observées pour tous les sérotypes partagés par rapport à Prevenar 13 (voir rubrique Propriétés pharmacodynamiques). La pertinence clinique de ces observations pour les personnes immunodéprimées est inconnue.
Population pédiatrique
Le risque potentiel d'apnée et la nécessité d'une surveillance respiratoire pendant 48 à 72 heures doivent être pris en compte lors de l'administration du schéma de primovaccination aux grands prématurés (nés à une date inférieure ou égale à 28 semaines de gestation), et en particulier à ceux présentant des antécédents d'immaturité respiratoire. Le bénéfice de la vaccination étant élevé dans ce groupe de nourrissons, la vaccination ne doit pas être suspendue ou retardée.
Excipients
Ce médicament contient du polysorbate 80 (voir rubrique 2). Le polysorbate 80 peut provoquer des réactions d'hypersensibilité.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c.-à-d. qu'il est essentiellement « sans sodium ».
Résumé du profil de sécurité
Population pédiatrique
La sécurité de Prevenar 20 a été évaluée chez 5 987 participants âgés de 6 semaines à moins de 18 ans dans le cadre de cinq études cliniques (une étude de phase II et quatre études de phase III), à savoir quatre études cliniques randomisées, en double aveugle, contrôlées contre comparateur actif et une étude clinique à bras unique ; 3 664 participants ont reçu au moins 1 dose de Prevenar 20 et 2 323 participants ont reçu Prevenar 13 (vaccin témoin).
Participants âgés de 6 semaines à moins de 15 mois
Des études cliniques ont été menées chez des nourrissons en bonne santé âgés de 6 semaines à moins de 15 mois en utilisant un calendrier à 3 doses ou un calendrier à 4 doses (voir rubrique Propriétés pharmacodynamiques). Dans ces études sur les nourrissons, 5 156 participants ont reçu au moins 1 dose de vaccin : 2 833 ont reçu Prevenar 20 et 2 323 ont reçu Prevenar 13. Dans l'ensemble, environ 90 % des participants de chaque groupe ont reçu toutes les doses jusqu'à la dose de rappel prédéfinie dans l'étude. Dans toutes les études, les réactions locales et les événements systémiques ont été recueillis après chaque dose et les événements indésirables (EI) ont été recueillis de la première dose jusqu'à 1 mois après la dernière vaccination du nourrisson et de la dose de rappel jusqu'à 1 mois après la dose de rappel dans toutes les études. Les événements indésirables graves ont été évalués jusqu'à 1 mois après la dernière dose dans l'étude de phase III B7471012 (étude 1012) et jusqu'à 6 mois après la dernière dose dans les études de phase III (études 1011, 1013) et dans l'étude de phase II (étude 1003).
Prevenar 20 a été bien toléré lorsqu'il a été administré selon un schéma à 3 doses et 4 doses, dans les populations de l'étude sur les nourrissons, avec de faibles taux de réactions locales sévères et d'événements systémiques, et la plupart des réactions se sont résolues dans un délai de 1 à 3 jours. Les pourcentages de participants ayant présenté des réactions locales et des événements systémiques après Prevenar 20 étaient généralement similaires à ceux observés après Prevenar 13. Les réactions locales et les événements systémiques les plus fréquemment rapportés après toute dose de Prevenar 20 étaient l'irritabilité, la somnolence et la douleur au site d'injection. Dans ces études, Prevenar 20 a été co- administré ou autorisé à être administré avec certains vaccins pédiatriques de routine (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
L'étude 1012 était une étude pivot de phase III, en double aveugle, randomisée et contrôlée contre comparateur actif, au cours de laquelle 601 nourrissons en bonne santé ont reçu Prevenar 20 selon un schéma à 3 doses. Les effets indésirables les plus fréquemment rapportés (> 10 %) après toute dose de Prevenar 20 étaient l'irritabilité (71,0 % à 71,9 %), la somnolence/l'hypersomnie (50,9 % à 61,2 %), la douleur au site d'injection (22, 8 % à 42,4 %), l'appétit diminué (24,7 % à 39,3 %), la rougeur au site d'injection (25,3 % à 36,9 %), le gonflement au site d'injection (21,4 % à 29,8 %) et la fièvre ≥ 38,0 °C (8,9 % à 24,3 %). La plupart des effets indésirables sont survenus dans les 1 à 2 jours suivant la vaccination et ont été de sévérité légère ou modérée et de courte durée (1 à 2 jours).
Les études 1011, 1013 et 1003 étaient des études en double aveugle, randomisées, contrôlées contre comparateur actif qui ont inclus 2 232 nourrissons en bonne santé, vaccinés avec Prevenar 20 selon un schéma à 4 doses. Les effets indésirables les plus fréquemment rapportés (> 10 %) observés après toute dose de Prevenar 20 chez les nourrissons étaient l'irritabilité (58,5 % à 70,6 %), la somnolence/l'hypersomnie (37,7 % à 66,2 %), la douleur au site d'injection (32,8 % à 45,5 %), l'appétit diminué (23,0 % à 26,4 %), la rougeur au site d'injection (22,6 % à 24,5 %) et le gonflement au site d'injection (15,1 % à 17,6 %). La plupart des effets indésirables ont été légers ou modérés après la vaccination et la plupart des effets ont disparu dans un délai de 1 à 3 jours. Les réactions sévères ont été peu fréquemment rapportées.
Dans l'étude 1013, les réactions locales et les événements systémiques dans le sous-groupe des prématurés (111 nourrissons nés entre 34 et moins de 37 semaines de gestation) étaient similaires ou inférieurs à ceux des nourrissons nés à terme de l'étude. Dans le sous-groupe des prématurés, la fréquence de toute réaction locale rapportée était de 31,7 % à 55,3 % dans le groupe Prevenar 20 et la fréquence de tout événement systémique était de 65,0 % à 85,5 % dans le groupe Prevenar 20.
Participants âgés de 15 mois à moins de 18 ans
Dans l'étude de phase III B7471014 (étude 1014), 831 participants âgés de 15 mois à moins de 18 ans ont reçu une dose unique de Prevenar 20 dans quatre groupes d'âge (209 participants âgés de 15 à moins de 24 mois ; 216 participants âgés de 2 ans à moins de 5 ans ; 201 participants âgés de 5 ans à moins de 10 ans ; et 205 participants âgés de 10 ans à moins de 18 ans). Les participants âgés de moins de 5 ans avaient reçu au moins 3 doses antérieures de Prevenar 13.
Les effets indésirables les plus fréquemment rapportés (> 10 %) observés après toute dose de Prevenar 20 chez les participants âgés de moins de 2 ans étaient l'irritabilité (61,8 %), la douleur au site d'injection (52,5 %), la somnolence/l'hypersomnie (41,7 %), la rougeur au site d'injection (37,7 %), l'appétit diminué (25,0 %), le gonflement au site d'injection (22,1 %) et la fièvre ≥ 38,0 °C (11,8 %). Chez les participants âgés de 2 ans et plus, les effets indésirables les plus fréquemment rapportés étaient la douleur au site d'injection (66,0 % à 82,9 %), la douleur musculaire (26,5 % à 48,3 %), la rougeur au site d'injection (15,1 % à 39,1 %), la fatigue (27,8 % à 37,2 %), les céphalées (5,6 % à 29,3 %) et le gonflement au site d'injection (15,6 % à 27,1 %).
Participants âgés de 18 ans et plus
La sécurité de Prevenar 20 a été évaluée chez 4 552 participants âgés de 18 ans et plus dans six essais cliniques (deux de phase I, un de phase II et trois de phase III), et chez 2 496 participants dans les groupes témoins.
Dans les essais de phase III, 4 263 participants ont reçu Prevenar 20. Ceux-ci incluaient 1 798 participants âgés de 18 à 49 ans, 334 participants âgés de 50 à 59 ans et 2 131 participants âgés de 60 ans et plus (1 138 étaient âgés de 65 ans et plus). Parmi les participants ayant reçu Prevenar 20 au cours des essais de phase III, 3 639 étaient naïfs de vaccins pneumococciques, 253 avaient déjà reçu Pneumovax 23 (vaccin pneumococcique polyosidique [23-valent] ; PPSV23) (≥ 1 à ≤ 5 ans avant le recrutement), 246 avaient déjà reçu Prevenar 13 uniquement (≥ 6 mois avant le recrutement), et 125 avaient déjà reçu Prevenar 13 suivi de PPSV23 (dose de PPSV23 ≥ 1 an avant le recrutement).
Les participants à l'essai B7471007 de phase III (étude pivot 1007), ont été évalués en vue de détecter des événements indésirables pendant 1 mois après la vaccination, et des événements indésirables graves jusqu'à 6 mois après la vaccination. Cette étude a inclus 447 participants âgés de 18 à 49 ans, 445 participants âgés de 50 à 59 ans, 1 985 participants âgés de 60 à 64 ans, 624 participants âgés de65 à 69 ans, 319 participants âgés de 70 à 79 ans et 69 participants âgés de ≥ 80 ans.
Chez les participants âgés de 18 à 49 ans des études 1007 et essai de phase III B7471008 (étude de cohérence de lot 1008), les effets indésirables les plus fréquemment rapportés ont été la douleur au site d'injection (79,2 %), la douleur musculaire (62,9 %), la fatigue (46,7 %), les céphalées (36,7 %) et la douleur articulaire (16,2 %). Chez les participants âgés de 50 à 59 ans de l'étude 1007, les effets indésirables les plus fréquemment rapportés ont été la douleur au site d'injection (72,5 %), la douleur musculaire (49,8 %), la fatigue (39,3 %), les céphalées (32,3 %) et la douleur articulaire (15,4 %).
Chez les participants âgés de ≥ 60 ans de l'étude 1007, les effets indésirables les plus fréquemment rapportés ont été la douleur au site d'injection (55,4 %), la douleur musculaire (39,1 %), la fatigue (30,2 %), les céphalées (21,5 %) et la douleur articulaire (12,6 %). Ces effets ont généralement été d'intensité légère ou modérée et ont disparu quelques jours après la vaccination.
L'étude de phase III B7471006 (étude 1006) a évalué Prevenar 20 chez des participants âgés de ≥ 65 ans avec un statut pneumococcique antérieur variable (ayant reçu PPSV23, Prevenar 13 ou Prevenar 13 suivi de PPSV23). Au cours de cette étude, les effets indésirables les plus fréquemment rapportés chez les participants étaient similaires à la fréquence de ceux décrits chez les participants âgés de ≥ 60 ans dans l'étude 1007, avec une douleur au point d'injection légèrement plus élevée (61,2 %) chez les participants ayant déjà reçu Prevenar 13, et des douleurs articulaires (16,8 %) chez les participants ayant déjà reçu Prevenar 13 suivi de PPSV23.
Liste des effets indésirables sous forme de tableau
Des listes d'effets indésirables issus des essais cliniques de phase II chez le nourrisson et de phase III chez des populations pédiatriques et adultes, ainsi que de l'expérience post-commercialisation sont présentées ci-dessous sous forme de tableau.
Effets indésirables issus des essais cliniques
Étant donné que Prevenar 20 contient les mêmes polyosides capsulaires conjugués spécifiques de 13 sérotypes et les mêmes excipients vaccinaux que Prevenar 13, les effets indésirables déjà identifiés pour Prevenar 13 ont été adoptés pour Prevenar 20. Le tableau 1 présente les effets indésirables rapportés au cours de l'étude de phase II chez le nourrisson et au cours des études de phase III chez des populations pédiatriques et adultes, sur la base de la fréquence la plus élevée parmi les effets indésirables, des réactions locales ou des événements systémiques, après la vaccination dans un groupe Prevenar 20 ou dans un ensemble de données intégré. Les données issues des études cliniques chez les nourrissons reflètent l'administration simultanée de Prevenar 20 et d'autres vaccins infantiles de routine.
Les effets indésirables sont répertoriés par classe de systèmes d'organes, par ordre décroissant de fréquence et de gravité. La fréquence est définie comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 1 : Effets indésirables observés lors des études
cliniques portant sur Prevenar 20
|
Classe de
systèmes d'organes |
Effets indésirables | Fréquence | ||
| Nourrissons/enfants/adolescents | Adultes | |||
|
De 6 semaines à moins de 5 ans |
De 5 ans à moins de 18 ans |
|||
|
Affections du système immunitaire |
Réaction d'hypersensibilité incluant œdème de la face, dyspnée, bronchospasme |
Rarea | - | Peu fréquent |
|
Troubles du métabolisme et de la nutrition |
Appétit diminué | Très fréquent | Très fréquenta | Très fréquenta |
|
Affections psychiatriques |
Irritabilité | Très fréquent | Très fréquenta | - |
| Pleurs | Peu fréquenta | - | - | |
|
Affections du système nerveux |
Somnolence/hypersomnie | Très fréquent | Très fréquenta | - |
|
Crises convulsives (notamment convulsions fébriles) |
Peu fréquent | - | - | |
|
Épisode hypotonique- hyporéactif |
Rarea | - | - | |
|
Sommeil agité/sommeil diminué |
Très fréquenta | Très fréquenta | - | |
| Céphalées | - | Très fréquent | Très fréquent | |
|
Affections
gastro- intestinales |
Diarrhée | Fréquent | Fréquenta | Peu fréquentb |
| Nausées | - | - | Peu fréquent | |
| Vomissements | Fréquent | Fréquenta | Peu fréquentb | |
|
Affections de la peau et du tissu sous-cutané |
Eruption cutanée | Fréquent | Fréquenta | Peu fréquentb |
| Angiœdème | - | - | Peu fréquent | |
|
Urticaire ou éruption cutanée de type urticarien |
Peu fréquent | Peu fréquent | - | |
|
Affections musculo- squelettiques et du tissu conjonctif |
Douleur musculaire | - | Très fréquent | Très fréquent |
| Douleur articulaire | - | Fréquent | Très fréquent | |
|
Troubles généraux et anomalies au site d'administration |
Fièvre (pyrexie) | Très fréquent | Peu fréquent | Fréquent |
|
Fièvre supérieure à 38,9 °C |
Fréquent | - | - | |
| Fatigue | - | Très fréquent | Très fréquent | |
|
Érythème au site de vaccination |
Très fréquent | Très fréquent | Fréquentb | |
|
Induration/gonflement au site de vaccination |
Très fréquent | Très fréquent | Fréquentb | |
|
Érythème ou induration/gonflement au site de vaccination (> 2,0 - 7,0 cm) |
Très fréquent (après la dose de rappel et chez les enfants plus âgés [de 2 à < 5 ans]) |
- | - | |
|
|
Fréquent (après le schéma infantile) |
- | - | |
|
Érythème
ou induration/gonflement au site de vaccination (> 7,0 cm) |
Peu fréquent | - | - | |
|
Douleur/sensibilité
au site de vaccination |
Très fréquent | Très fréquent | Très fréquent | |
|
Douleur/sensibilité
au site de vaccination entraînant une limitation des mouvements des membres |
Fréquent | Fréquent | Très fréquenta | |
|
Prurit
au site de vaccination |
- | - | Peu fréquent | |
| Lymphadénopathie | - | - | Peu fréquent | |
|
Urticaire
au site de vaccination |
- | - | Peu fréquent | |
| Frissons | - | - | Peu fréquentb | |
|
Hypersensibilité
au site de vaccination |
Rarec | - | - | |
a. Ces
fréquences sont basées sur les effets indésirables (EI) rapportés au cours des
études cliniques portant sur Prevenar 13, car ces EI
n'ont pas été rapportés au cours des études Prevenar
20 menées sur les nourrissons (phases II et III), les
enfants et adolescents âgés de moins de 18 ans et les adultes âgés de 18 ans et
plus (phase III) ; par conséquent, la fréquence est indéterminée.
b. Événement rapporté au cours des études cliniques menées chez les adultes avec Prevenar 13 à une fréquence « très fréquent » (≥ 1/10).
c. EI non rapporté pour Prevenar 13, bien que l'urticaire au site d'injection, le prurit au site d'injection et la dermatite au site d'injection aient été rapportés au cours de l'expérience post-commercialisation de Prevenar 13.
b. Événement rapporté au cours des études cliniques menées chez les adultes avec Prevenar 13 à une fréquence « très fréquent » (≥ 1/10).
c. EI non rapporté pour Prevenar 13, bien que l'urticaire au site d'injection, le prurit au site d'injection et la dermatite au site d'injection aient été rapportés au cours de l'expérience post-commercialisation de Prevenar 13.
Sécurité lors de l'administration concomitante d'un vaccin chez l'adulte
Lorsque Prevenar 20 a été administré à des adultes âgés de ≥ 65 ans en même temps que la troisième dose (de rappel) d'un vaccin à ARNm (à nucléoside modifié) contre la COVID-19, le profil de tolérance a généralement ressemblé à celui du vaccin à ARNm (à nucléoside modifié) contre la COVID-19 administré seul. Quelques différences ont été observées au niveau du profil de sécurité par rapport à l'administration de Prevenar 20 seul. Dans l'essai de phase III B7471026 (étude 1026), la fièvre (13,0 %) et les frissons (26,5 %) ont été rapportés comme « très fréquents » lors de la co- administration. Un cas de sensations vertigineuses (0,5 %) a également été rapporté dans le groupe de co-administration.
Effets indésirables issus de l'expérience post-commercialisation
Le tableau 2 inclut les effets indésirables qui ont été spontanément rapportés lors de l'utilisation de Prevenar 13 dans des populations pédiatriques et adultes, au cours de la période post- commercialisation, pouvant également survenir avec Prevenar 20. L'expérience de sécurité post- commercialisation avec Prevenar 13 est pertinente pour Prevenar 20, car Prevenar 20 contient tous les composants (conjugués polysaccharidiques et excipients) de Prevenar 13. Ces événements ont été rapportés volontairement par une population de taille incertaine. Par conséquent, il n'est pas possible d'estimer de manière fiable leur fréquence ou d'établir, pour tous les événements, une relation de cause à effet avec l'exposition au vaccin.
Tableau 2.
Effets indésirables de Prevenar 13 rapportés au cours
de l'expérience post-commercialisation
| Classe de systèmes d'organes |
Fréquence indéterminée
|
|
Affections
hématologiques et du système lymphatique |
Lymphadénopathie localisée dans la région du site de vaccination |
| Affections du système immunitaire |
Réaction
anaphylactique/anaphylactoïde, y compris choc |
| Affections de la peau et du tissu sous-cutané | Angiœdème, érythème polymorphe |
|
Troubles
généraux et anomalies au site d'administration |
Dermatite
au site de vaccination, urticaire au site de vaccination, prurit au site de vaccination |
Événements
rapportés spontanément au cours de l'expérience post-commercialisation de Prevenar 13 ; par conséquent, les fréquences n'ont pas pu
être estimées à partir des données disponibles pour Prevenar
20 et sont considérées comme indéterminées.
Informations supplémentaires concernant les populations particulières dans les études avec Prevenar 13
Les participants âgés de 6 à < 18 ans et infectés par le VIH présentent des fréquences d'effets indésirables similaires à celles du tableau 1, à l'exception de la fièvre (11 % à 19 %), de la douleur articulaire (24 % à 42 %) et des vomissements (8 % à 18 %), qui sont très fréquents. Les participants âgés de ≥ 18 ans infectés par le VIH présentent des fréquences d'effets indésirables similaires à celles du tableau 1, à l'exception de la fièvre (5 % à 18 %) et des vomissements (8 % à 12 %) qui ont été très fréquents et des nausées (< 1 % à 3 %) qui ont été fréquentes.
Les participants âgés de 2 à < 18 ans ayant subi une GCSH présentent des fréquences d'effets indésirables similaires à celles du tableau 1, à l'exception de la douleur au site de vaccination entraînant une limitation des mouvements des membres (5 % à 15 %), des vomissements (6 % à 21 %), de la diarrhée (15 % à 32 %) et de la douleur articulaire (25 % à 32 %), qui sont très fréquents. Les participants âgés de ≥ 18 ans ayant subi une GCSH présentent des fréquences d'effets indésirables similaires à celles du tableau 1, à l'exception de la fièvre (4 % à 15 %), des vomissements (6 % à21 %) et de la diarrhée (25 % à 36 %) qui ont été très fréquents.
Les participants âgés de 6 à < 18 ans atteints de drépanocytose présentent des fréquences d'effets indésirables similaires à celles du tableau 1, à l'exception de la douleur au site de vaccination entraînant une limitation des mouvements des membres (11 % à 16 %), de la fièvre (21 % à 22 %), des vomissements (13 % à 15 %), de la diarrhée (13 % à 25 %) et de la douleur articulaire (40 % à 45 %), qui sont très fréquents.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du
médicament est importante. Elle permet une surveillance continue du
rapport bénéfice/risque du médicament. Les professionnels de santé
déclarent tout effet indésirable suspecté via le système national de
déclaration : Agence nationale de sécurité du médicament et des
produits de santé (ANSM) et réseau des Centres Régionaux de
Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
INFORMER IMMEDIATEMENT LE MEDECIN en cas de gonflement du visage, des lèvres, de la bouche, de la langue ou de la gorge, essoufflement, respiration sifflante.
Grossesse
Il n'existe pas de données concernant l'utilisation de Prevenar 20 chez la femme enceinte.
Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects en ce qui concerne la toxicité sur la reproduction.
L'administration de Prevenar 20 pendant la grossesse ne doit être envisagée que lorsque les bénéfices potentiels l'emportent sur les risques potentiels pour la mère et le fœtus.
Allaitement
On ne sait pas si Prevenar 20 est excrété dans le lait maternel.
Fertilité
Aucune donnée n'est disponible concernant l'effet de Prevenar 20 sur la fertilité humaine. Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects sur la fertilité féminine (voir rubrique Données de sécurité préclinique).
Des vaccins injectables différents doivent toujours être administrés dans des sites de vaccination différents.
Ne pas mélanger Prevenar 20 avec d'autres vaccins/médicaments dans la même seringue.
Population pédiatrique
Chez les nourrissons et les enfants âgés de 6 semaines à moins de 5 ans, Prevenar 20 peut être administré en même temps que l'un des antigènes vaccinaux suivants, sous forme de vaccins monovalents ou combinés : diphtérie, tétanos, coqueluche acellulaire, hépatite B, Haemophilus influenzae de type b, poliomyélite inactivée, rougeole, oreillons, rubéole et varicelle. Lors des essais cliniques, les vaccins contre les rotavirus ont été autorisés à être administrés en concomitance avec Prevenar 20 et aucun incident de sécurité n'a été rapporté.
Personnes âgées de 18 ans et plus
Prevenar 20 peut être administré en même temps que le vaccin contre la grippe saisonnière (QIV ; antigène de surface, inactivé, avec adjuvant). Chez les sujets présentant des affections sous-jacentes associées à un risque élevé de développement d'une maladie pneumococcique pouvant engager le pronostic vital, il peut être envisagé de respecter un intervalle entre les administrations du QIV et de Prevenar 20 (d'environ 4 semaines, par exemple). Au cours d'une étude randomisée, en double aveugle, (B7471004) menée chez des adultes âgés de 65 ans et plus, la réponse immunitaire a été formellement non inférieure, cependant des titres numériquement plus faibles ont été observés pour tous les sérotypes pneumococciques inclus dans Prevenar 20 en cas d'administration concomitante avec le vaccin contre la grippe saisonnière (QIV, antigène de surface, inactivé, avec adjuvant) par rapport à Prevenar 20 administré seul. La pertinence clinique de ce résultat est inconnue.
Prevenar 20 peut être administré en même temps qu'un vaccin à ARNm (à nucléoside modifié) contre la COVID-19.
Il n'existe aucune donnée concernant l'administration concomitante de Prevenar 20 avec d'autres vaccins.
Posologie
Il est recommandé que les nourrissons qui reçoivent une première dose de Prevenar 20 terminent le schéma de vaccination avec Prevenar 20.
| Calendrier vaccinal pour les nourrissons et les enfants âgés de 6 semaines à 15 mois | |
| Schéma à 4 doses (primovaccination de trois doses suivies d'une dose de rappel) | La primovaccination pour les nourrissons comprend trois doses, de 0,5 mL chacune, la première dose étant habituellement administrée à l'âge de 2 mois, avec un intervalle d'au moins 4 semaines entre les doses. La première dose peut être administrée dès l'âge de 6 semaines. La quatrième dose (rappel) est recommandée entre 11 et 15 mois (voir rubrique Propriétés pharmacodynamiques). |
| Calendrier vaccinal pour les personnes âgées de 18 ans et plus | |
| Personnes âgées de 18 ans et plus | Prevenar 20 doit être administré en dose unique aux personnes âgées de 18 ans et plus. La nécessité d'une revaccination avec une dose ultérieure de Prevenar 20 n'a pas été établie. Aucune donnée sur la vaccination séquentielle avec d'autres vaccins pneumococciques ou une dose de rappel n'est disponible pour Prevenar 20. D'après l'expérience clinique acquise avec Prevenar 13 (un vaccin pneumococcique conjugué composé de 13 polyosides conjugués également présents dans Prevenar 20), si l'utilisation du vaccin pneumococcique polyosidique 23-valent (Pneumovax 23 [PPSV23]) est jugée appropriée, Prevenar 20 doit être administré en premier (voir rubrique Propriétés pharmacodynamiques). |
Population pédiatrique
Il n'existe pas de données ou uniquement des données limitées pour Prevenar 20 chez les nourrissons âgés de moins de 6 semaines, les prématurés, les nourrissons et les enfants plus âgés non vaccinés ou partiellement vaccinés (voir rubriques Mises en garde spéciales et précautions d'emploi, Effets indésirables et Propriétés pharmacodynamiques). Les recommandations posologiques suivantes sont principalement basées sur l'expérience acquise avec Prevenar 13.
Nourrissons âgés de moins de 6 semaines
La sécurité et l'efficacité de Prevenar 20 chez les nourrissons âgés de
moins de 6 semaines n'ont pas été établies. Aucune donnée n'est
disponible.
Nourrissons prématurés (moins de 37 semaines de gestation)
Le schéma vaccinal recommandé pour Prevenar 20 comprend quatre doses,
de 0,5 mL chacune. La primovaccination pour les nourrissons comprend
trois doses, la première dose étant administrée à l'âge de 2 mois, avec
un intervalle d'au moins 4 semaines entre les doses. La première dose
peut être administrée dès l'âge de 6 semaines. La quatrième dose
(rappel) est recommandée entre 11 et 15 mois (voir rubriques Mises en garde spéciales et précautions d'emploi et Propriétés pharmacodynamiques).
Nourrissons non vaccinés âgés de 7 mois à moins de 12 mois
Deux doses, de 0,5 mL chacune, avec un intervalle d'au moins 4 semaines
entre les doses. Une troisième dose est recommandée au cours de la
deuxième année de vie.
Enfants non vaccinés âgés de 12 mois à moins de 24 mois
Deux doses, de 0,5 mL chacune, avec un intervalle d'au moins 8 semaines entre les doses.
Enfants non vaccinés âgés de 2 ans à moins de 5 ans
Une dose unique de 0,5 mL.
Enfants âgés de 15 mois à moins de 5 ans ayant déjà été complètement vaccinés avec Prevenar 13
Une dose unique (0,5 mL) administrée sur une base individuelle
conformément aux recommandations officielles pour déclencher des
réponses immunitaires contre les sérotypes supplémentaires.
Si Prevenar 13 a été administré précédemment, au moins 8 semaines doivent s'écouler avant d'administrer Prevenar 20 (voir rubrique Propriétés pharmacodynamiques).
Enfants et adolescents âgés de 5 ans à moins de 18 ans, indépendamment d'une vaccination antérieure avec Prevenar 13
Une dose unique (0,5 mL) administrée sur une base individuelle conformément aux recommandations officielles.
Si Prevenar 13 a été administré précédemment, au moins 8 semaines doivent s'écouler avant d'administrer Prevenar 20 (voir rubrique Propriétés pharmacodynamiques).
Populations particulières
Il n'existe aucune donnée avec Prevenar 20 dans les populations particulières.
Les données issues des études cliniques menées avec Prevenar 13 (un vaccin pneumococcique conjugué composé de 13 polyosides conjugués également présents dans Prevenar 20) sont disponibles chez les enfants et les adultes présentant un risque plus élevé d'infection pneumococcique, notamment des enfants et des adultes immunodéprimés infectés par le virus de l'immunodéficience humaine (VIH) ou ayant subi une greffe de cellules souches hématopoïétiques (GCSH), ainsi que les enfants atteints de drépanocytose (voir rubriques Mises en garde spéciales et précautions d'emploi et Propriétés pharmacodynamiques).
Sur la base de ces données, la posologie suivante a été recommandée pour Prevenar 13 :
- Il a été recommandé aux personnes présentant un risque plus élevé d'infection pneumococcique (par exemple, les personnes atteintes de drépanocytose ou d'infection par le VIH), y compris celles qui ont déjà été vaccinées avec 1 ou plusieurs doses de PPSV23, de recevoir au moins 1 dose de Prevenar 13.
- Chez les personnes ayant subi une GCSH, le schéma vaccinal recommandé avec Prevenar 13 comprenait 4 doses, de 0,5 mL chacune. La primovaccination comprenait 3 doses, la première dose étant administrée 3 à 6 mois après la GCSH et avec un intervalle d'au moins 4 semaines entre les doses. Une dose de rappel était recommandée 6 mois après l'administration de la troisième dose (voir rubrique Propriétés pharmacodynamiques).
L'administration recommandée de Prevenar 13 peut être prise en compte pour guider la vaccination avec Prevenar 20 dans les populations à haut risque. Pour plus d'informations sur les réponses aux vaccins pneumococciques chez les personnes immunodéprimées, voir également les rubriques Mises en garde spéciales et précautions d'emploi et Propriétés pharmacodynamiques.
Mode d'administration
Pour administration par voie intramusculaire uniquement.
Le vaccin (0,5 mL) doit être administré par injection intramusculaire. Les sites privilégiés sont la face antérolatérale de la cuisse (muscle vaste latéral) chez les nourrissons ou le muscle deltoïde du bras chez les enfants et les adultes. Prevenar 20 doit être administré en prenant soin d'éviter l'injection dans ou à proximité des nerfs et des vaisseaux sanguins.
Pour les instructions concernant la manipulation du vaccin avant administration, voir la rubrique Précautions particulières d'élimination et de manipulation.
Durée de conservation :
2 ans
Précautions particulières de conservation :
À conserver au réfrigérateur (entre 2 °C et 8 °C). Les seringues préremplies doivent être conservées au réfrigérateur, horizontalement, afin de réduire le temps de remise en suspension.
Ne pas congeler. Éliminer le vaccin s'il a été congelé.
D'un point de vue microbiologique, une fois sorti du réfrigérateur, le vaccin doit être utilisé immédiatement.
Les données de stabilité indiquent que le vaccin est stable pendant 96 heures lorsqu'il est conservé à des températures comprises entre 8 °C et 25 °C ou pendant 72 heures lorsqu'il est conservé à des températures comprises entre 0 °C et 2 °C. À la fin de ces périodes, Prevenar 20 doit être utilisé ou éliminé. Ces données sont destinées à guider les professionnels de la santé en cas d'excursion de température temporaire uniquement.
En l'absence d'études de compatibilité, ce vaccin ne doit pas être mélangé avec d'autres médicaments.
Un surdosage avec Prevenar 20 est peu probable en raison de sa présentation sous forme de seringue préremplie.
Classe pharmacothérapeutique : vaccins, vaccins pneumococciques, Code ATC : J07AL02
Mécanisme d'action
Prevenar 20 contient 20 polysaccharides capsulaires pneumococciques, tous conjugués à la protéine vectrice CRM197, qui modifie la réponse immunitaire au polysaccharide, passant d'une réponse indépendante des lymphocytes T à une réponse dépendante des lymphocytes T. La réponse dépendante des lymphocytes T entraîne une augmentation de la réponse en anticorps et induit des anticorps fonctionnels (associés à l'opsonisation, à la phagocytose et à la destruction des pneumocoques) pour protéger contre la maladie pneumococcique, ainsi que la génération de lymphocytes B à mémoire, ce qui permet une réponse anamnestique (rappel) lors d'une nouvelle exposition à la bactérie.
Les réponses immunitaires chez les enfants et les adultes, après une exposition à Streptococcus pneumoniae ou après une vaccination pneumococcique, peuvent être déterminées en mesurant les réponses des IgG ou de l'activité opsonophagocytaire (OPA). L'OPA mesure l'activité fonctionnelle des anticorps et est considérée comme une importante mesure immunologique substitutive de la protection contre les maladies pneumococciques chez les adultes. Chez les enfants, plusieurs critères d'immunogénicité sont utilisés pour l'évaluation clinique des vaccins pneumococciques conjugués, notamment la proportion d'enfants vaccinés atteignant un taux d'anticorps IgG spécifique au sérotype correspondant à ≥ 0,35 µg/mL selon le test immuno-enzymatique (ELISA) de l'OMS ou une valeur équivalente spécifique au test.
Les réponses immunitaires spécifiques au sérotype qui sont en corrélation avec la protection individuelle contre les maladies pneumococciques n'ont pas été clairement définies.
Efficacité clinique
Aucune étude d'efficacité n'a été réalisée avec Prevenar 20.
Données d'immunogénicité
Études cliniques portant sur Prevenar 20 chez les nourrissons, les enfants et les adolescents
L'immunogénicité a été évaluée par les taux de réponse IgG spécifiques au sérotype (la proportion de participants atteignant un taux d'IgG spécifiques au sérotype ≥ 0,35 µg/mL ou une valeur équivalente spécifique au test) et les MGC d'IgG 1 mois après la primovaccination et 1 mois après la dose de rappel. Les MGT de l'OPA ont également été mesurées 1 mois après la primovaccination et après l'administration de la dose de rappel. La concentration prédéfinie correspondant à 0,35 µg/mL selon le test ELISA de l'OMS (ou une valeur seuil équivalente spécifique au test) n'est applicable qu'au niveau de la population et ne peut pas être utilisée pour prédire la protection individuelle ou spécifique au sérotype contre les MPI. Il n'existe aucune corrélation de protection pour la pneumonie et l'otite moyenne aiguë (OMA).
Deux études cliniques de phase III
(étude 1011, étude 1012) et une étude clinique de phase II (étude 1003)
ont évalué l’immunogénicité de Prevenar 20 selon un schéma à 3 doses ou
4 doses chez les nourrissons. Une étude de phase III B7471027 (étude
1027) a évalué l’immunogénicité d’une seule dose de rappel ou de 2
doses de Prevenar 20 chez des nourrissons âgés de 12 mois à moins de 24
mois ayant précédemment reçu 2 doses de Prevenar 13. Une étude de phase
III (étude 1014) menée chez des enfants âgés de 15 mois à moins de 18
ans a évalué une dose unique de Prevenar 20.
Réponses immunitaires après 3 et 4 doses d'un schéma de vaccination des nourrissons à 4 doses
Dans l'étude 1011 menée aux États-Unis et à Porto Rico, 1 991 nourrissons en bonne santé âgés de 2 mois (≥ 42 à ≤ 98 jours) au moment du consentement et nés à > 36 semaines de gestation, ont été randomisés (1:1) et vaccinés soit avec Prevenar 20 soit avec Prevenar 13 à environ 2, 4, 6 et 12 à 15 mois. Les participants ont également reçu d'autres vaccins pédiatriques, notamment un vaccin combiné contenant la diphtérie, le tétanos, la coqueluche (acellulaire), l'hépatite B (ADNr), la poliomyélite (inactivé) et un vaccin conjugué Haemophilus influenzae de type b (adsorbé) pour les 3 doses, ainsi qu'un vaccin combiné contre la rougeole, les oreillons et la rubéole, et un vaccin contre la varicelle pour la dose de rappel. Les vaccins contre le rotavirus et la grippe pouvaient être co-administrés dans le cadre de l'étude.
Un mois après l'administration de la troisième dose pour les nourrissons, la non-infériorité (NI) pour la différence entre les pourcentages de participants présentant des concentrations prédéfinies d'IgG spécifiques à un sérotype (avec un critère de NI de 10 %) a été satisfaite pour 9 des 13 sérotypes appariés et n'a pas été atteinte pour 4 sérotypes (sérotypes 3, 4, 9V et 23F) (tableau 3). Six des 7 sérotypes supplémentaires ont également satisfait au critère de non-infériorité par rapport au résultat le plus faible pour un sérotype vaccinal dans le groupe Prevenar 13 (à l'exception du sérotype 3) ; le sérotype 12F n'a pas satisfait au critère de non-infériorité statistique. Les MGC d'IgG 1 mois après la 3e dose de Prevenar 20 étaient non inférieures (avec un critère de NI de 0,5 pour le rapport des moyennes géométriques [RMG] d'IgG) à celles du groupe Prevenar 13 pour les 13 sérotypes appariés. Le critère de NI était également respecté pour les 7 sérotypes supplémentaires ayant les MGC d'IgG les plus faibles (à l'exception du sérotype 3) parmi les sérotypes du vaccin dans le groupe Prevenar 13 (tableau 3).
Les taux d'anticorps pour les 7 sérotypes supplémentaires étaient significativement plus élevés que ceux du sérotype correspondant dans le groupe Prevenar 13 (tableaux 3 et 4).
Un mois après l'administration de la dose de rappel, la NI pour les MGC d'IgG (avec un critère de NI de 0,5 pour le RMG d'IgG) a été atteint pour les 13 sérotypes appariés. Le critère de NI a également été atteint pour les 7 sérotypes supplémentaires ayant la plus faible MGC d'IgG (à l'exception du sérotype 3) parmi les sérotypes du vaccin dans le groupe Prevenar 13 (tableau 4). Bien que la non-infériorité n'ait pas été formellement testée pour ce critère d'évaluation, les différences observées (Prevenar 20 - Prevenar 13) dans les pourcentages de participants présentant des concentrations prédéfinies d'IgG spécifiques à un sérotype 1 mois après la 4e dose étaient supérieures à -10 % pour les 13 sérotypes appariés à l'exception du sérotype 3 (-16,4 %, IC -21,0 % ; -11,8 %). Pour les 7 sérotypes supplémentaires, les différences observées dans le pourcentage de participants ayant des concentrations prédéfinies d'IgG spécifiques à un sérotype 1 mois après la 4e dose allaient de -11,5 % (sérotype 12F) à 1,8 % (sérotypes 15B, 22F et 33F) (tableau 4).
Tableau
3. Pourcentage de participants présentant des concentrations prédéfinies d'Ig G antipneumococciques et des MGC d'IgG antipneumococciques
(µg/mL) un mois après la troisième dose d'un
schéma à 4 doses, étude 1011a
|
Pourcentage de participants
présentant des concentrations d'IgG prédéfiniesb |
MGC d'IgG | |||||
|
Prevenar 20
Nc = 831 - 833 |
Prevenar 13 Nc = 801 - 802 |
Différence (Prevenar 20- Prevenar 13) |
Prevenar 20 Nc = 831 - 833 |
Prevenar 13 Nc = 801 - 802 |
Prevenar 20 /Prevenar 13 |
|
| % | % | % (IC à95 %d) | MGCe | MGCe | RMG (IC à95 %e) | |
| Sérotypes | ||||||
|
1 |
84,9 |
91,1 |
-6,3
(-9,4 ; -3,1) |
0,74 |
1,14 |
0,65
(0,59 ; 0,72) |
|
3 |
40,5 |
55,2 |
-14,8 (-19,5 ; -10,0) |
0,36 |
0,51 |
0,70
(0,64 ; 0,76) |
|
4 |
78,2 |
87,5 |
-9,4
(-13,0 ; -5,8) |
0,75 |
1,08 |
0,70 (0,63 ; 0,78) |
|
5 |
86,2 |
90,5 |
-4,3 (-7,5 ; -1,2) |
0,66 |
0,96 |
0,69 (0,61 ; 0,77) |
|
6A |
94,2 |
96,1 |
-1,9 (-4,0 ; 0,2) |
1,95 |
2,69 |
0,72 (0,65 ; 0,81) |
|
6B |
88,3 |
92,4 |
-4,1 (-7,0 ; -1,2) |
0,61 |
1,02 |
0,60
(0,51 ; 0,70) |
|
7F |
96,4 |
97,3 |
-0,9 (-2,6 ; 0,9) |
1,71 |
2,29 |
0,75
(0,69 ; 0,81) |
|
9V |
80,3 |
88,8 |
-8,5 (-12,0 ; -5,0) |
0,87 |
1,21 |
0,72 (0,65 ; 0,80) |
|
14 |
94,2 |
95,4 |
-1,2 (-3,4 ; 1,0) |
2,16 |
2,72 |
0,79
(0,71 ; 0,89) |
|
18C |
87,3 |
89,4 |
-2,1 (-5,3 ; 1,0) |
1,31 |
1,71 |
0,77
(0,70 ; 0,84) |
|
19A |
96,3 |
98,0 |
-1,7
(-3,4 ; -0,1) |
0,72 |
0,91 |
0,79
(0,72 ; 0,86) |
|
19F |
96,0 |
95,9 |
0,2 (-1,8 ; 2,1) |
1,59 |
2,00 |
0,79 (0,73 ; 0,86) |
|
23F |
74,3 |
83,2 |
-8,9 (-12,8 ; -4,9) |
0,82 |
1,25 |
0,66
(0,58 ; 0,75) |
| Sérotypes supplémentairesf | ||||||
|
8 |
95,8 |
83,2f |
12,6
(9,8 ; 15,6) |
1,80 |
0,91g |
1,98 (1,81 ; 2,16) |
|
10A |
88,0 |
83,2f |
4,8
(1,4 ; 8,3) |
1,21 |
0,91g |
1,32
(1,18 ; 1,49) |
|
11A |
90,0 |
83,2f |
6,9 (3,6 ; 10,2) |
1,39 |
0,91g |
1,52 (1,39 ; 1,67) |
|
12F |
48,0 |
83,2f |
-35,1 (-39,4 ; -30,8) |
0,55 |
0,91g |
0,60
(0,54 ; 0,67) |
| Sérotypes | ||||||
|
15B |
97,0 |
83,2f |
13,8 (11,1 ; 16,8) |
4,40 |
0,91g |
4,82 (4,39 ; 5,30) |
|
22F |
98,7 |
83,2f |
15,5 (12,9 ; 18,3) |
3,71 |
0,91g |
4,06 (3,68 ; 4,48) |
|
33F |
89,3 |
83,2f |
6,1 (2,8 ; 9,5) |
1,49 |
0,91g |
1,64 (1,46 ; 1,83) |
Abréviations
: IC = intervalle de confiance ; dLIA = dosage
immunologique direct basé sur Luminex ; ELISA =
dosage immuno-enzymatique ; MGC = moyennes géométriques
des concentrations ; RMG = rapport des moyennes géométriques ; IgG = immunoglobulines G ; LIQ = limite inférieure de
quantification.
Remarque : la non-infériorité d'un sérotype a été démontrée si la limite inférieure de l'IC bilatéral à 95 % pour la différence de pourcentage (Prevenar 20 - Prevenar 13) était > -10 % ou si la limite inférieure de l'IC bilatéral à 95 % pour le RMG (Prevenar 20/Prevenar 13) était > 0,5 pour ce sérotype.
Remarque : les résultats de test inférieurs à la LIQ ont été fixés à 0,5 × LIQ dans l'analyse.
a. L'étude 1011 a été menée aux États-Unis et dans le territoire de Porto Rico (NCT04382326).
b. Les niveaux prédéfinis pour les sérotypes de Prevenar 13 proviennent d'une étude de synthèse publiée (Tan CY, et al. 2018) utilisant les résultats obtenus après la primovaccination des nourrissons, avant la dose de rappel et après la dose de rappel (schéma de primovaccination pour les nourrissons à 3 doses suivies d'une dose de rappel), sauf pour le sérotype 19A, pour lequel les résultats obtenus uniquement après la primovaccination des nourrissons ont été utilisés. Pour les 7 sérotypes supplémentaires, les niveaux prédéfinis proviennent d'une évaluation de concordance (dLIA clinique pour re-test ELISA) des données d'une étude de phase II B7471003, qui utilise également le schéma à 3 doses pour les nourrissons suivies d'une dose de rappel.
c. N = nombre de participants présentant des concentrations d'IgG valides.
d. IC bilatéral basé sur la méthode Miettinen et Nurminen.
e. Les MGC, les RMG et les IC bilatéraux associés ont été calculés en exponentialisant les moyennes et les différences moyennes (Prevenar 20 - Prevenar 13) du logarithme des concentrations et des IC correspondants (sur la base de la distribution t de Student).
f. Pour les différences de pourcentage des 7 sérotypes supplémentaires, les résultats des IgG du sérotype 23F (sérotype Prevenar 13 avec le pourcentage le plus bas, à l'exception du sérotype 3) dans le groupe Prevenar 13 ont été utilisés dans les comparaisons pour la non-infériorité. Les pourcentages de participants ayant des concentrations d'IgG prédéfinies pour les sérotypes 8, 10A, 11A, 12F, 15B, 22F et 33F dans le groupe Prevenar 13 étaient respectivement de 1,4 %, 1,9 %, 1,4 %, 0,1 %, 1,2 %, 1,4 % et 1,5 %.
g. Pour les RMG des 7 sérotypes supplémentaires, les résultats des IgG du sérotype 19A (sérotype Prevenar 13 avec la MGC la plus faible à l'exception du sérotype 3) dans le groupe Prevenar 13 ont été utilisés dans les comparaisons pour la non-infériorité. Les MGC d'IgG des sérotypes 8, 10A, 11A, 12F, 15B, 22F et 33F dans le groupe Prevenar 13 étaient respectivement de 0,02 µg/mL, 0,01 µg/mL, 0,02 µg/mL, 0,01 µg/mL, 0,03 µg/mL, 0,01 µg/mL et 0,02 µg/mL.
Remarque : la non-infériorité d'un sérotype a été démontrée si la limite inférieure de l'IC bilatéral à 95 % pour la différence de pourcentage (Prevenar 20 - Prevenar 13) était > -10 % ou si la limite inférieure de l'IC bilatéral à 95 % pour le RMG (Prevenar 20/Prevenar 13) était > 0,5 pour ce sérotype.
Remarque : les résultats de test inférieurs à la LIQ ont été fixés à 0,5 × LIQ dans l'analyse.
a. L'étude 1011 a été menée aux États-Unis et dans le territoire de Porto Rico (NCT04382326).
b. Les niveaux prédéfinis pour les sérotypes de Prevenar 13 proviennent d'une étude de synthèse publiée (Tan CY, et al. 2018) utilisant les résultats obtenus après la primovaccination des nourrissons, avant la dose de rappel et après la dose de rappel (schéma de primovaccination pour les nourrissons à 3 doses suivies d'une dose de rappel), sauf pour le sérotype 19A, pour lequel les résultats obtenus uniquement après la primovaccination des nourrissons ont été utilisés. Pour les 7 sérotypes supplémentaires, les niveaux prédéfinis proviennent d'une évaluation de concordance (dLIA clinique pour re-test ELISA) des données d'une étude de phase II B7471003, qui utilise également le schéma à 3 doses pour les nourrissons suivies d'une dose de rappel.
c. N = nombre de participants présentant des concentrations d'IgG valides.
d. IC bilatéral basé sur la méthode Miettinen et Nurminen.
e. Les MGC, les RMG et les IC bilatéraux associés ont été calculés en exponentialisant les moyennes et les différences moyennes (Prevenar 20 - Prevenar 13) du logarithme des concentrations et des IC correspondants (sur la base de la distribution t de Student).
f. Pour les différences de pourcentage des 7 sérotypes supplémentaires, les résultats des IgG du sérotype 23F (sérotype Prevenar 13 avec le pourcentage le plus bas, à l'exception du sérotype 3) dans le groupe Prevenar 13 ont été utilisés dans les comparaisons pour la non-infériorité. Les pourcentages de participants ayant des concentrations d'IgG prédéfinies pour les sérotypes 8, 10A, 11A, 12F, 15B, 22F et 33F dans le groupe Prevenar 13 étaient respectivement de 1,4 %, 1,9 %, 1,4 %, 0,1 %, 1,2 %, 1,4 % et 1,5 %.
g. Pour les RMG des 7 sérotypes supplémentaires, les résultats des IgG du sérotype 19A (sérotype Prevenar 13 avec la MGC la plus faible à l'exception du sérotype 3) dans le groupe Prevenar 13 ont été utilisés dans les comparaisons pour la non-infériorité. Les MGC d'IgG des sérotypes 8, 10A, 11A, 12F, 15B, 22F et 33F dans le groupe Prevenar 13 étaient respectivement de 0,02 µg/mL, 0,01 µg/mL, 0,02 µg/mL, 0,01 µg/mL, 0,03 µg/mL, 0,01 µg/mL et 0,02 µg/mL.
Tableau 4. Pourcentage de participants présentant des concentrations prédéfinies d'IgG antipneumococciques et des MGC d'IgG antipneumococciques (µg/mL) un mois après la quatrième dose d'un schéma à 4 doses, étude 1011a
|
Pourcentage de participants
présentant
des concentrations d'IgG prédéfiniesb |
MGC d'IgG |
|||||
|
Prevenar 20 Nc = 753 -755 |
Prevenar 13
Nc = 744 - 745 |
Différence (Prevenar 20 -Prevenar 13) |
Prevenar 20 Nc = 753 - 755 |
Prevenar 13
Nc = 744 - 745 |
Prevenar 20 /Prevenar 13 |
|
| % | % | % (IC à95 %d) | MGCe | MGCe | RMG (IC à95 %e) | |
| Sérotypes | ||||||
|
1 |
95,5 |
98,1 |
-2,6
(-4,5 ; -0,9) |
1,47 |
2,12 |
0,69
(0,63 ; 0,76) |
|
3 |
60,8 |
77,2 |
-16,4 (-21,0 ; -11,8) |
0,56 |
0,85 |
0,66
(0,61 ; 0,73) |
|
4 |
98,8 |
98,9 |
-0,1 (-1,3 ; 1,1) |
3,77 |
4,84 |
0,78 (0,70 ; 0,86) |
|
5 |
98,8 |
98,7 |
0,2
(-1,1 ; 1,4) |
1,87 |
2,51 |
0,74
(0,67 ; 0,82) |
|
6A |
99,5 |
99,9 |
-0,4 (-1,2 ; 0,3) |
9,01 |
11,69 |
0,77 (0,70 ; 0,85) |
|
6B |
99,1 |
99,5 |
-0,4 (-1,4 ; 0,6) |
4,01 |
5,74 |
0,70
(0,62 ; 0,79) |
|
7F |
99,5 |
99,9 |
-0,4 (-1,2 ; 0,3) |
3,91 |
5,18 |
0,76 (0,70 ; 0,82) |
|
9V |
98,3 |
98,9 |
-0,6 (-2,0 ; 0,6) |
3,44 |
4,30 |
0,80 (0,73 ; 0,88) |
|
14 |
99,2 |
99,6 |
-0,4 (-1,4 ; 0,5) |
5,68 |
6,34 |
0,90 (0,81 ; 1,00) |
|
18C |
97,6 |
97,9 |
-0,2 (-1,8 ; 1,3) |
3,46 |
4,69 |
0,74
(0,67 ; 0,82) |
|
19A |
99,9 |
99,7 |
0,1 (-0,5 ; 0,9) |
3,53 |
4,13 |
0,85
(0,77 ; 0,94) |
|
19F |
98,8 |
98,7 |
0,2
(-1,1 ; 1,4) |
5,01 |
5,79 |
0,86 (0,78 ; 0,96) |
|
23F |
96,6 |
97,9 |
-1,3 (-3,1 ; 0,4) |
3,95 |
6,18 |
0,64
(0,57 ; 0,72) |
| Sérotypes supplémentaires | ||||||
|
8 |
99,2 |
97,9f |
1,4
(0,1 ; 2,8) |
3,97 |
2,12g |
1,87
(1,71 ; 2,06) |
|
10A |
98,7 |
97,9f |
0,8 (-0,5 ; 2,3) |
6,22 |
2,12g |
2,94
(2,64 ; 3,26) |
|
11A |
98,7 |
97,9f |
0,8 (-0,5 ; 2,3) |
3,53 |
2,12g |
1,67
(1,51 ; 1,84) |
|
12F |
86,4 |
97,9f |
-11,5 (-14,3 ; -8,9) |
1,85 |
2,12g |
0,88
(0,79 ; 0,97) |
|
15B |
99,6 |
97,9f |
1,8 (0,7 ; 3,1) |
12,59 |
2,12g |
5,95
(5,39 ; 6,55) |
|
22F |
99,6 |
97,9f |
1,8
(0,7 ; 3,1) |
10,60 |
2,12g |
5,01
(4,54 ; 5,52) |
|
33F |
99,6 |
97,9f |
1,8 (0,7 ; 3,1) |
9,31 |
2,12g |
4,40 (3,99 ; 4,85) |
Abréviations
: IC = intervalle de confiance ; dLIA = dosage
immunologique direct basé sur Luminex ; ELISA =
dosage immuno-enzymatique ; MGC = moyennes
géométriques des concentrations ; RMG = rapport des moyennes géométriques ; IgG = immunoglobulines G ; LIQ = limite inférieure de
quantification.
Remarque : la non-infériorité d'un sérotype a été démontrée si la limite inférieure de l'IC bilatéral à 95 % pour le RMG (Prevenar 20/Prevenar 13) était > 0,5 pour ce sérotype.
Remarque : les résultats de test inférieurs à la LIQ ont été fixés à 0,5 × LIQ dans l'analyse.
a. L'étude 1011 a été menée aux États-Unis et dans le territoire de Porto Rico (NCT04382326).
b. Les niveaux prédéfinis pour les sérotypes de Prevenar 13 proviennent d'une étude de synthèse publiée (Tan CY, et al. 2018) utilisant les résultats obtenus après la primovaccination des nourrissons, avant la dose de rappel et après la dose de rappel (schéma de primovaccination pour les nourrissons à 3 doses suivies d'une dose de rappel), sauf pour le sérotype 19A, pour lequel les résultats obtenus uniquement après la primovaccination des nourrissons ont été utilisés. Pour les 7 sérotypes supplémentaires, les niveaux prédéfinis proviennent d'une évaluation de concordance (dLIA clinique pour re-test ELISA) des données d'une étude de phase II B7471003, qui utilise également le schéma à 3 doses pour les nourrissons suivies d'une dose de rappel.
c. N = nombre de participants présentant des concentrations d'IgG valides.
d. IC bilatéral basé sur la méthode Miettinen et Nurminen.
e. Les MGC, les RMG et les IC bilatéraux associés ont été calculés en exponentialisant les moyennes et les différences moyennes (Prevenar 20 - Prevenar 13) du logarithme des concentrations et des IC correspondants (sur la base de la distribution t de Student).
f. Pour les différences de pourcentage des 7 sérotypes supplémentaires, les résultats des IgG du sérotype 18C ou 23F (sérotype Prevenar 13 avec le pourcentage le plus bas, à l'exception du sérotype 3) dans le groupe Prevenar 13 ont été utilisés dans les comparaisons pour la non-infériorité. Les pourcentages de participants ayant des concentrations d'IgG prédéfinies pour les sérotypes 8, 10A, 11A, 12F, 15B, 22F et 33F dans le groupe Prevenar 13 étaient respectivement de 4,2 %, 2,2 %, 3,8 %, 0,1 %, 3,1 %, 1,7 % et 2,3 %.
g. Pour les RMG des 7 sérotypes supplémentaires, les résultats des IgG du sérotype 1 (sérotype Prevenar 13 avec la MGC la plus faible à l'exception du sérotype 3) dans le groupe Prevenar 13 ont été utilisés dans les comparaisons pour la non-infériorité. Les MGC d'IgG des sérotypes 8, 10A, 11A, 12F, 15B, 22F et 33F dans le groupe Prevenar 13 étaient respectivement de 0,03 µg/mL, 0,01 µg/mL, 0,02 µg/mL, 0,01 µg/mL, 0,02 µg/mL, 0,00 µg/mL et 0,01 µg/mL.
Remarque : la non-infériorité d'un sérotype a été démontrée si la limite inférieure de l'IC bilatéral à 95 % pour le RMG (Prevenar 20/Prevenar 13) était > 0,5 pour ce sérotype.
Remarque : les résultats de test inférieurs à la LIQ ont été fixés à 0,5 × LIQ dans l'analyse.
a. L'étude 1011 a été menée aux États-Unis et dans le territoire de Porto Rico (NCT04382326).
b. Les niveaux prédéfinis pour les sérotypes de Prevenar 13 proviennent d'une étude de synthèse publiée (Tan CY, et al. 2018) utilisant les résultats obtenus après la primovaccination des nourrissons, avant la dose de rappel et après la dose de rappel (schéma de primovaccination pour les nourrissons à 3 doses suivies d'une dose de rappel), sauf pour le sérotype 19A, pour lequel les résultats obtenus uniquement après la primovaccination des nourrissons ont été utilisés. Pour les 7 sérotypes supplémentaires, les niveaux prédéfinis proviennent d'une évaluation de concordance (dLIA clinique pour re-test ELISA) des données d'une étude de phase II B7471003, qui utilise également le schéma à 3 doses pour les nourrissons suivies d'une dose de rappel.
c. N = nombre de participants présentant des concentrations d'IgG valides.
d. IC bilatéral basé sur la méthode Miettinen et Nurminen.
e. Les MGC, les RMG et les IC bilatéraux associés ont été calculés en exponentialisant les moyennes et les différences moyennes (Prevenar 20 - Prevenar 13) du logarithme des concentrations et des IC correspondants (sur la base de la distribution t de Student).
f. Pour les différences de pourcentage des 7 sérotypes supplémentaires, les résultats des IgG du sérotype 18C ou 23F (sérotype Prevenar 13 avec le pourcentage le plus bas, à l'exception du sérotype 3) dans le groupe Prevenar 13 ont été utilisés dans les comparaisons pour la non-infériorité. Les pourcentages de participants ayant des concentrations d'IgG prédéfinies pour les sérotypes 8, 10A, 11A, 12F, 15B, 22F et 33F dans le groupe Prevenar 13 étaient respectivement de 4,2 %, 2,2 %, 3,8 %, 0,1 %, 3,1 %, 1,7 % et 2,3 %.
g. Pour les RMG des 7 sérotypes supplémentaires, les résultats des IgG du sérotype 1 (sérotype Prevenar 13 avec la MGC la plus faible à l'exception du sérotype 3) dans le groupe Prevenar 13 ont été utilisés dans les comparaisons pour la non-infériorité. Les MGC d'IgG des sérotypes 8, 10A, 11A, 12F, 15B, 22F et 33F dans le groupe Prevenar 13 étaient respectivement de 0,03 µg/mL, 0,01 µg/mL, 0,02 µg/mL, 0,01 µg/mL, 0,02 µg/mL, 0,00 µg/mL et 0,01 µg/mL.
Les MGT de l'OPA pour les 13 sérotypes appariés dans le groupe Prevenar 20 étaient généralement comparables aux MGT de l'OPA dans le groupe Prevenar 13 1 mois après la troisième dose pour les nourrissons et elles étaient légèrement inférieures à celles du groupe Prevenar 13 pour la plupart des sérotypes après la dose de rappel. La variabilité des données de l'OPA est due à la petite taille des échantillons, et l'interprétation de la pertinence clinique des MGT de l'OPA légèrement inférieures n'est pas connue. Les MGT de l'OPA observés pour les 7 sérotypes supplémentaires étaient nettement plus élevées dans le groupe Prevenar 20 que dans le groupe Prevenar 13. Les réponses immunitaires à Prevenar 20 révèlent également une augmentation des concentrations d'IgG et des MGT de l'OPA après la dose de rappel, ce qui indique qu'une réponse mémoire a été déclenchée par les 3 doses pour les nourrissons.
Réponses immunitaires IgG antipneumococciques après 2 et 3 doses d'un schéma de vaccination à 3 doses
Au cours de l'étude 1012, 1 204 nourrissons âgés de 2 mois (≥ 42 à ≤ 112 jours) au moment du consentement et nés à > 36 semaines de gestation ont été randomisés (1:1) et vaccinés avec Prevenar 20 ou Prevenar 13. La première dose a été administrée au moment du recrutement, la deuxième environ 2 mois plus tard et la troisième à l'âge d'environ 11 à 12 mois.
Un mois après l'administration de 2 doses pour les nourrissons, les MGC d'IgG observées étaient non inférieures à celles du groupe Prevenar 13 pour 9 des 13 sérotypes appariés. Pour 4 autres des 13 sérotypes appariés (6A, 6B, 9V et 23F), le critère statistique de non-infériorité (borne inférieure de l'intervalle de confiance à 95 % du rapport des MGC d'IgG > 0,5) n'était pas rempli. Les pourcentages de participants présentant des concentrations prédéfinies d'IgG spécifiques à un sérotype 1 mois après la deuxième dose de Prevenar 20 pour 4 des 13 sérotypes appariés étaient non inférieurs à ceux du groupe Prevenar 13 sur la base d'un critère de non-infériorité d'une différence de 10 % ; et 9 des 13 sérotypes appariés (1, 3, 4, 5, 6A, 6B, 9V, 18C et 23F) n'ont pas satisfait à la non-infériorité.
Les
réponses immunitaires aux 7 sérotypes supplémentaires
après Prevenar 20 étaient non inférieures à la MGC d'IgG la plus basse parmi les 13 sérotypes
(sérotype 6B) dans Prevenar
13. Pour les 7 sérotypes supplémentaires, les
pourcentages de participants présentant des concentrations prédéfinies d'IgG spécifiques à un sérotype 1
mois après la deuxième dose de Prevenar 20 pour 5 des
7 sérotypes supplémentaires étaient non inférieurs au
sérotype présentant le pourcentage le plus faible
parmi les 13 sérotypes (sérotype
6B) dans le groupe Prevenar 13 et les sérotypes 10A et 12F n'ont pas satisfait au critère
statistique de non-infériorité. La pertinence clinique de ces résultats n'est
pas connue. En outre, les MGC d'IgG pour les 7 sérotypes supplémentaires étaient plus élevées que les MGC d'IgG des sérotypes
correspondants dans le groupe Prevenar 13 après deux
doses pour les nourrissons.
Un mois après la troisième dose (de rappel), les MGC d'IgG
observées de Prevenar 20 étaient non inférieures à
celles du groupe Prevenar 13 pour 12 des 13 sérotypes appariés, à l'exception du sérotype
6B, et les 7 sérotypes supplémentaires étaient non
inférieurs à la MGC d'IgG la plus faible du groupe Prevenar 13. En outre, les MGC d'IgG
pour les 7 sérotypes supplémentaires étaient plus
élevées que les MGC d'IgG des sérotypes
correspondants dans le groupe Prevenar 13 après la
dose de rappel.
Les réponses fonctionnelles, mesurées par les MGT de l'OPA, pour les 13 sérotypes appariés 1 mois après la deuxième dose pour les nourrissons et 1 mois après la dose de rappel dans le groupe Prevenar 20 étaient généralement similaires aux MGT de l'OPA observées dans le groupe Prevenar 13 pour la plupart des sérotypes et les MGT de l'OPA observées étaient considérablement plus élevées pour les 7 sérotypes supplémentaires aux deux temps d'évaluation dans le groupe Prevenar 20 que dans le groupe Prevenar 13. Des augmentations des réponses en anticorps IgG et OPA après la deuxième et la troisième dose de Prevenar 20 ont été observées pour les 20 sérotypes, y compris ceux n'ayant pas atteint le seuil de non-infériorité, ce qui indique l'existence d'une mémoire immunologique.
Enfants âgés de 12 mois à moins de 18 ans (études 1027 et 1014)
Enfants âgés de 12 mois à moins de 24 mois antérieurement vaccinés avec Prevenar 13 (étude 1027)
Dans une étude multicentrique randomisée, en double aveugle partiel
(étude 1027), 356 participants âgés de 12 mois à moins de 24 mois ayant
déjà reçu 2 doses de Prevenar 13 ont été recrutés et randomisés pour
recevoir 1 ou 2 doses de rappel de Prevenar 20 ou une dose unique de
Prevenar 13 (témoin). Dans le groupe recevant 2 doses de Prevenar 20,
la deuxième dose a été administrée environ 2 mois après la première
dose.
Des réponses immunitaires IgG contre les 13 sérotypes appariés ont été
observées après 1 ou 2 doses de Prevenar 20 avec des MGC d’IgG
numériquement plus élevées pour la majorité des 13 sérotypes appariés
après 1 dose de Prevenar 20 qu’après 2 doses de Prevenar 20. Les MGC
d’IgG observées 1 mois après la dernière vaccination contre les 13
sérotypes appariés étaient plus faibles après 1 ou 2 doses de Prevenar
20 qu’après 1 dose de Prevenar 13. Des réponses immunitaires IgG contre
les 7 sérotypes supplémentaires ont été observées après 1 ou 2 doses de
Prevenar 20, avec des réponses IgG numériquement plus élevées après 2
doses de Prevenar 20 qu’après une dose unique. Les MGC d’IgG observées
pour les 7 sérotypes supplémentaires (non couverts par Prevenar 13)
étaient faibles 1 mois après une seule dose de rappel de Prevenar 13.
Des réponses de l’OPA ont été induites pour les 20 sérotypes avec des
tendances similaires à celles décrites ci-dessus pour les MGC d’IgG.
Enfants et adolescents âgés de 15 mois à moins de 18 ans (étude 1014)
Dans une étude multicentrique à bras unique (étude 1014), les participants ont été recrutés dans l'étude par groupe d'âge (environ 200 participants par groupe) pour recevoir une dose unique de Prevenar 20 comme décrit ci-dessous.
Enfants âgés de 15 mois à moins de 24 mois précédemment vaccinés avec Prevenar 13
Dans le groupe des enfants âgés de 15 mois à moins de 24 mois, les participants avaient déjà été vaccinés avec 3 ou 4 doses de Prevenar 13. Des augmentations des concentrations d'IgG ont été observées pour les 20 sérotypes du vaccin entre la période précédant l'administration de Prevenar 20 et le mois suivant. Les rapports des moyennes géométriques des titres (RMGT) d'IgG observés pour les 7 sérotypes supplémentaires allaient de 27,9 à 1 847,7.
Enfants âgés de 24 mois à moins de 5 ans précédemment vaccinés avec Prevenar 13
Dans
le groupe des enfants âgés de 24 mois à moins de 5 ans, les participants
avaient déjà été vaccinés avec 3 ou 4 doses de Prevenar
13. Des augmentations des concentrations d'IgG ont
été observées pour les 20 sérotypes du vaccin entre
la période précédant l'administration de Prevenar 20
et le mois suivant. Les RMGT d'IgG observés pour les
7 sérotypes supplémentaires allaient de 36,6 à 796,2.
Pour les 7 sérotypes supplémentaires, 71,2 % - 94,6 %
présentaient une augmentation ≥ 4 fois des titres OPA.
Enfants et adolescents âgés de 5 ans à moins de 18 ans non vaccinés ou précédemment vaccinés avec Prevenar 13
Dans les groupes d'âge de 5 ans à moins de 10 ans et de 10 ans à moins de 18 ans, indépendamment des antécédents de vaccination avec Prevenar 13, Prevenar 20 a suscité des réponses immunitaires IgG et OPA robustes contre les 20 sérotypes du vaccin après une dose unique chez les participants âgés de 5 à moins de 18 ans. Les RMGT de l'OPA allaient de 11,5 à 499,0 pour les 7 sérotypes supplémentaires et des augmentations des MGT de l'OPA ont été observées pour les 20 sérotypes du vaccin.
Nourrissons prématurés
Aucune donnée d'immunogénicité n'est disponible pour Prevenar 20 chez les nourrissons prématurés. D'après l'expérience acquise avec Prevenar et Prevenar 13, des réponses immunitaires sont déclenchées chez les prématurés, bien qu'elles puissent être plus faibles que chez les nourrissons nés à terme. La sécurité et la tolérance de Prevenar 20 ont été évaluées au cours d'une étude de phase III (étude 1013), qui incluait 111 nourrissons nés dans la période de prématurité tardive (nés entre 34 et 37 semaines de gestation) dans la population totale de l'étude. Les participants ont été randomisés pour recevoir un schéma de 4 doses de Prevenar 20 (N = 77) ou de Prevenar 13 (N = 34).
Essais cliniques portant sur Prevenar 20 chez l'adulte
Trois essais cliniques de phase III, B7471006, B7471007 et B7471008 (étude 1006, étude 1007 et étude 1008), ont été menés aux États-Unis et en Suède en vue d'évaluer l'immunogénicité de Prevenar 20 dans différents groupes d'âge d'adultes et chez des participants qui étaient soit naïfs de vaccin pneumococcique, soit précédemment vaccinés avec Prevenar 13, PPSV23 ou les deux.
Chaque étude a inclus des participants qui étaient en bonne santé ou immunocompétents présentant des affections sous-jacentes stables, comme une maladie cardiovasculaire chronique, une maladie pulmonaire chronique, des troubles rénaux, un diabète sucré, une maladie hépatique chronique, ainsi que des affections et des comportements médicaux à risque (par exemple, tabagisme) connus pour augmenter le risque de pneumonie pneumococcique grave et de MIP. Dans l'étude pivot (étude 1007), ces facteurs de risque ont été identifiés chez 34 %, 32 % et 26 % des participants âgés de 60 ans et plus, de 50 à 59 ans et de 18 à 49 ans, respectivement. Un état médical stable était défini comme un état médical n'ayant pas nécessité de modification significative du traitement au cours des 6 semaines précédentes (c'est-à-dire le passage à une nouvelle catégorie de traitement en raison de l'aggravation de la maladie) ou toute hospitalisation pour aggravation de la maladie dans les 12 semaines précédant la réception du vaccin à l'étude.
Dans chaque étude, les réponses immunitaires provoquées par Prevenar 20 et les vaccins pneumococciques témoins ont été mesurées grâce à un test d'activité opsonophagocytaire (OPA). Les tests OPA mesurent les anticorps fonctionnels contre S. pneumoniae.
Comparaison des réponses immunitaires de Prevenar 20 à celles de Prevenar 13 et de PPSV23
Dans le cadre d'un essai clinique de non-infériorité, randomisé, contrôlé contre comparateur actif, en double aveugle (étude pivot 1007) portant sur Prevenar 20 aux États-Unis et en Suède, des participants de 18 ans et plus naïfs de vaccin pneumococcique ont été recrutés dans 1 des 3 cohortes en fonction de leur âge au moment du recrutement (18 à 49 ans, 50 à 59 ans et ≥ 60 ans) et ont été randomisés pour recevoir Prevenar 20 ou un vaccin témoin. Les participants âgés de 60 ans et plus ont été randomisés selon un rapport de 1/1 pour recevoir Prevenar 20 (n = 1 507) suivi, 1 mois plus tard, de l'administration d'un placebo ou de Prevenar 13 (n = 1 490), et de l'administration de PPSV23 1 mois plus tard. Les participants âgés de 18 à 49 ans et de 50 à 59 ans ont été répartis au hasard (rapport de 3/1) ; ils ont reçu une dose de Prevenar 20 (18 à 49 ans : n = 335 ; 50 à 59 ans : n = 334) ou de Prevenar 13 (18 à 49 ans : n = 112 ; 50 à 59 ans : n = 111).
Les MGT de l'OPA spécifiques du sérotype ont été mesurées avant la première vaccination et 1 mois après chaque vaccination. La non-infériorité des réponses immunitaires, les MGT de l'OPA 1 mois après la vaccination, avec Prevenar 20 par rapport à un vaccin témoin pour un sérotype a été déclarée si la limite inférieure de l'IC à 95 % bilatéral pour le rapport des MGT (Prevenar 20/Prevenar 13 ; Prevenar 20/PPSV23) pour ce sérotype était supérieure à 0,5.
Chez les participants âgés de 60 ans et plus, les réponses immunitaires aux 13 sérotypes appariés provoquées par Prevenar 20 étaient non inférieures à celles provoquées par Prevenar 13 pour les mêmes sérotypes 1 mois après la vaccination. En général, des moyennes géométriques des titres numériquement plus faibles ont été observées avec Prevenar 20 dans les sérotypes appariés par rapport à Prevenar 13 (tableau 5) ; cependant, la pertinence clinique de ces résultats est inconnue.
Les réponses immunitaires induites par Prevenar 20 à 6/7 sérotypes supplémentaires étaient non inférieures à celles induites par PPSV23 aux mêmes sérotypes 1 mois après la vaccination. La réponse au sérotype 8 n'a pas satisfait au critère de non-infériorité statistique préétabli (la limite inférieure de l'IC bilatéral à 95 % pour le rapport des MGT est de 0,49 au lieu de > 0,50) (tableau 5). La pertinence clinique de cette observation est inconnue. Des analyses de soutien pour d'autres critères d'évaluation du sérotype 8 dans le groupe Prevenar 20 ont révélé des résultats favorables. Il s'agit notamment d'une augmentation du RMGT de 22,1 entre avant la vaccination et 1 mois après la vaccination, 77,8 % des participants ont obtenu une augmentation ≥ 4 fois des titres OPA entre avant la vaccination et 1 mois après la vaccination, et 92,9 % des participants ont obtenu des titres OPA ≥ LIQ 1 mois après la vaccination.
Tableau 5. MGT de l'OPA 1 mois après
la vaccination chez les participants âgés de 60 ans et plus ayant reçu Prevenar 20 par rapport à Prevenar
13 pour les 13 sérotypes appariés et à PPSV23 pour
les 7 sérotypes supplémentaires (étude 1007)a,b,c,d
|
Prevenar 20 (N = 1 157 - 1 430) |
Prevenar 13 (N = 1 390 - 1 419) |
PPSV23 (N = 1 201 - 1 319) |
Comparaison entre les vaccins |
||
| MGTe | MGTe | MGTe | Rapport des MGTe | IC à 95 %e | |
| Sérotype | |||||
| 1 | 123 | 154 | 0,80 | 0,71 ; 0,90 | |
| 3 | 41 | 48 | 0,85 | 0,78 ; 0,93 | |
| 4 | 509 | 627 | 0,81 | 0,71 ; 0,93 | |
| 5 | 92 | 110 | 0,83 | 0,74 ; 0,94 | |
| 6A | 889 | 1 165 | 0,76 | 0,66 ; 0,88 | |
| 6B | 1 115 | 1 341 | 0,83 | 0,73 ; 0,95 | |
| 7F | 969 | 1 129 | 0,86 | 0,77 ; 0,96 | |
| 9V | 1 456 | 1 568 | 0,93 | 0,82 ; 1,05 | |
| 14 | 747 | 747 | 1,00 | 0,89 ; 1,13 | |
| 18C | 1 253 | 1 482 | 0,85 | 0,74 ; 0,97 | |
| 19A | 518 | 645 | 0,80 | 0,71 ; 0,90 | |
| 19F | 266 | 333 | 0,80 | 0,70 ; 0,91 | |
| 23F | 277 | 335 | 0,83 | 0,70 ; 0,97 | |
| Sérotypes supplémentaires | |||||
| 8 | 466 | 848 | 0,55 | 0,49 ; 0,62 | |
| 10A | 2 008 | 1 080 | 1,86 | 1,63 ; 2,12 | |
| 11A | 4 427 | 2 535 | 1,75 | 1,52 ; 2,01 | |
| 12F | 2 539 | 1 717 | 1,48 | 1,27 ; 1,72 | |
| 15B | 2 398 | 769 | 3,12 | 2,62 ; 3,71 | |
| 22F | 3 666 | 1 846 | 1,99 | 1,70 ; 2,32 | |
| 33F | 5 126 | 3 721 | 1,38 | 1,21 ; 1,57 | |
Abréviations
: IC = intervalle de confiance ; MGT = moyenne géométrique des titres ; LIQ =
limite inférieure de quantification ; N = nombre de participants ; OPA =
activité opsonophagocytaire ; PPSV23 = vaccin pneumococcique polyosidique
(23-valent).
a. L'étude 1007 a été menée aux États-Unis et en Suède.
b. La non-infériorité pour un sérotype était satisfaite si la limite inférieure de l'IC à 95 % bilatéral pour le rapport des MGT (rapport Prevenar 20/comparateur) était supérieure à 0,5 (critère de non- infériorité de 2 fois).
c. Les résultats des tests inférieurs à la LIQ ont été fixés à 0,5 × LIQ dans l'analyse.
d. Population d'immunogénicité évaluable.
e. Les MGT et les rapports des MGT ainsi que les IC bilatéraux associés étaient basés sur l'analyse des titres OPA transformés en logarithme à l'aide d'un modèle de régression avec le groupe vaccinal, le sexe, le tabagisme, l'âge au moment de la vaccination en années et les titres OPA transformés en logarithme à l'inclusion.
a. L'étude 1007 a été menée aux États-Unis et en Suède.
b. La non-infériorité pour un sérotype était satisfaite si la limite inférieure de l'IC à 95 % bilatéral pour le rapport des MGT (rapport Prevenar 20/comparateur) était supérieure à 0,5 (critère de non- infériorité de 2 fois).
c. Les résultats des tests inférieurs à la LIQ ont été fixés à 0,5 × LIQ dans l'analyse.
d. Population d'immunogénicité évaluable.
e. Les MGT et les rapports des MGT ainsi que les IC bilatéraux associés étaient basés sur l'analyse des titres OPA transformés en logarithme à l'aide d'un modèle de régression avec le groupe vaccinal, le sexe, le tabagisme, l'âge au moment de la vaccination en années et les titres OPA transformés en logarithme à l'inclusion.
Immunogénicité chez les participants âgés de 18 à 59 ans
Dans l'étude 1007, les participants âgés de 50 à 59 ans et les participants âgés de 18 à 49 ans ont été répartis au hasard (rapport de 3/1) pour recevoir 1 vaccination avec Prevenar 20 ou Prevenar 13. Les MGT de l'OPA spécifiques du sérotype ont été mesurées avant la vaccination et 1 mois après la vaccination. Avec les deux vaccins, des réponses immunitaires plus élevées ont été observées chez les jeunes participants par rapport aux participants plus âgés. Une analyse de non-infériorité de Prevenar 20 dans le groupe d'âge le plus jeune par rapport à Prevenar 20 chez les participants âgés de 60 à 64 ans par sérotype a été réalisée pour soutenir l'indication chez les adultes âgés de 18 à 49 ans et de 50 à 59 ans. La non-infériorité était déclarée si la limite inférieure de l'IC à 95 % bilatéral pour le rapport des MGT (Prevenar 20 chez les participants âgés de 18 à 49 ans/60 à 64 ans et de 50 à 59 ans/60 à 64 ans) pour chacun des 20 sérotypes était > 0,5. Prevenar 20 a provoqué des réponses immunitaires aux 20 sérotypes du vaccin dans les deux groupes d'âge les plus jeunes qui n'étaient pas inférieures aux réponses des participants âgés de 60 à 64 ans 1 mois après la vaccination (tableau 6).
Bien qu'elle n'ait pas été prévue comme comparateur actif pour les évaluations d'immunogénicité dans l'étude, une analyse descriptive post hoc a révélé des MGT de l'OPA généralement numériquement plus faibles 1 mois après Prevenar 20 pour les sérotypes appariés par rapport à Prevenar 13 chez les participants âgés de 18 à 59 ans ; cependant, la pertinence clinique de ces résultats est inconnue.
Comme indiqué ci-dessus, les personnes présentant des facteurs de risque ont été incluses dans cette étude. Dans tous les groupes d'âge étudiés, en général, une réponse immunitaire numériquement plus faible a été observée chez les participants présentant des facteurs de risque par rapport aux participants sans facteurs de risque. La pertinence clinique de cette observation est inconnue.
Tableau 6. Comparaison des MGT de l'OPA 1 mois après Prevenar 20 chez les participants âgés de 18 à 49 ans ou de
50 à 59 ans et chez les participants âgés de 60 à 64 ans (étude 1007)a,b,c,d
|
18 - 49 ans (N = 251 - 317) |
60 - 64 ans (N = 765 - 941) |
18 - 49 ans par rapport à 60 - 64 ans |
50 - 59 ans (N = 266 - 320) |
60 - 64 ans (N = 765 - 941) |
50 - 59 ans par rapport à 60 - 64 ans |
|
|
MGTe |
MGTe |
Rapport des MGTe (IC à 95 %)e |
MGTe |
MGTe |
Rapport des MGTe (IC à 95 %)e |
|
| Sérotype | ||||||
|
1 |
163 |
132 |
1,23
(1,01 ; 1,50) |
136 |
132 |
1,03 (0,84 ; 1,26) |
|
3 |
42 |
42 |
1,00
(0,87 ; 1,16) |
43 |
41 |
1,06
(0,92 ; 1,22) |
|
4 |
1 967 |
594 |
3,31 (2,65 ; 4,13) |
633 |
578 |
1,10 (0,87 ; 1,38) |
|
5 |
108 |
97 |
1,11
(0,91 ; 1,36) |
85 |
97 |
0,88
(0,72 ; 1,07) |
|
6A |
3 931 |
1 023 |
3,84 (3,06 ; 4,83) |
1 204 |
997 |
1,21
(0,95 ; 1,53) |
|
6B |
4 260 |
1 250 |
3,41
(2,73 ; 4,26) |
1 503 |
1 199 |
1,25 (1,00 ; 1,56) |
|
7F |
1 873 |
1 187 |
1,58 (1,30 ; 1,91) |
1 047 |
1 173 |
0,89
(0,74 ; 1,07) |
|
9V |
6 041 |
1 727 |
3,50 (2,83 ; 4,33) |
1 726 |
1 688 |
1,02
(0,83 ; 1,26) |
|
14 |
1 848 |
773 |
2,39 (1,93 ; 2,96) |
926 |
742 |
1,25 (1,01 ; 1,54) |
|
18C |
4 460 |
1 395 |
3,20 (2,53 ; 4,04) |
1 805 |
1 355 |
1,33 (1,06 ; 1,68) |
|
19A |
1 415 |
611 |
2,31 (1,91 ; 2,81) |
618 |
600 |
1,03 (0,85 ; 1,25) |
|
19F |
655 |
301 |
2,17 (1,76 ; 2,68) |
287 |
290 |
0,99 (0,80 ; 1,22) |
|
23F |
1 559 |
325 |
4,80 (3,65 ; 6,32) |
549 |
328 |
1,68 (1,27 ; 2,22) |
| Sérotypes supplémentaires | ||||||
|
8 |
867 |
508 |
1,71 (1,38 ; 2,12) |
487 |
502 |
0,97 (0,78 ; 1,20) |
|
10A |
4 157 |
2 570 |
1,62 (1,31 ; 2,00) |
2 520 |
2 437 |
1,03 (0,84 ; 1,28) |
|
11A |
7 169 |
5 420 |
1,32 (1,04 ; 1,68) |
6 417 |
5 249 |
1,22 (0,96 ; 1,56) |
|
12F |
5 875 |
3 075 |
1,91 (1,51 ; 2,41) |
3 445 |
3 105 |
1,11 (0,88 ; 1,39) |
|
15B |
4 601 |
3 019 |
1,52 (1,13 ; 2,05) |
3 356 |
2 874 |
1,17 (0,88 ; 1,56) |
|
22F |
7 568 |
4 482 |
1,69 (1,30 ; 2,20) |
3 808 |
4 228 |
0,90 (0,69 ; 1,17) |
|
33F |
7 977 |
5 693 |
1,40 (1,10 ; 1,79) |
5 571 |
5 445 |
1,02 (0,81 ; 1,30) |
Abréviations
: IC = intervalle de confiance ; MGT = moyenne géométrique des titres ; LIQ =
limite inférieure de quantification ; N = nombre de participants ; OPA =
activité opsonophagocytaire ; PPSV23 = vaccin pneumococcique polyosidique
(23-valent).
a. L'étude 1007 a été menée aux États-Unis et en Suède.
b. La non-infériorité pour un sérotype était satisfaite si la limite inférieure de l'IC bilatéral à 95 % pour le rapport des MGT (rapport groupe d'âge le plus jeune/groupe d'âge de 60 à 64 ans) était supérieure à 0,5 (critère de non-infériorité de 2 fois).
c. Les résultats des tests inférieurs à la LIQ ont été fixés à 0,5 × LIQ dans l'analyse.
d. Population d'immunogénicité évaluable.
e. Les MGT, les rapports des MGT et les IC bilatéraux associés étaient basés sur l'analyse des titres OPA transformés en logarithme à l'aide d'un modèle de régression avec le groupe d'âge, le sexe, le tabagisme et les titres OPA transformés en logarithme à l'inclusion. Les comparaisons entre les participants âgés de 18 à 49 ans et les participants âgés de 60 à 64 ans et entre les participants âgés de 50 à 59 ans et les participants âgés de 60 à 64 ans reposaient sur des modèles de régression distincts.
a. L'étude 1007 a été menée aux États-Unis et en Suède.
b. La non-infériorité pour un sérotype était satisfaite si la limite inférieure de l'IC bilatéral à 95 % pour le rapport des MGT (rapport groupe d'âge le plus jeune/groupe d'âge de 60 à 64 ans) était supérieure à 0,5 (critère de non-infériorité de 2 fois).
c. Les résultats des tests inférieurs à la LIQ ont été fixés à 0,5 × LIQ dans l'analyse.
d. Population d'immunogénicité évaluable.
e. Les MGT, les rapports des MGT et les IC bilatéraux associés étaient basés sur l'analyse des titres OPA transformés en logarithme à l'aide d'un modèle de régression avec le groupe d'âge, le sexe, le tabagisme et les titres OPA transformés en logarithme à l'inclusion. Les comparaisons entre les participants âgés de 18 à 49 ans et les participants âgés de 60 à 64 ans et entre les participants âgés de 50 à 59 ans et les participants âgés de 60 à 64 ans reposaient sur des modèles de régression distincts.
Immunogénicité de Prevenar 20 chez les adultes précédemment vaccinés avec le vaccin pneumococcique
Un essai clinique randomisé, en ouvert, de phase III (étude 1006) a décrit les réponses immunitaires à Prevenar 20 chez des participants âgés de 65 ans et plus précédemment vaccinés avec PPSV23, avec Prevenar 13, ou avec Prevenar 13 suivi de PPSV23. Les participants précédemment vaccinés avec Prevenar 13 (Prevenar 13 uniquement ou suivi de PPSV23) ont été recrutés dans des sites aux États- Unis, tandis que les participants précédemment vaccinés avec PPSV23 uniquement ont également été recrutés dans des sites suédois (35,5 % dans cette catégorie).
Prevenar 20 a provoqué des réponses immunitaires aux 20 sérotypes du vaccin chez les participants âgés de 65 ans et plus ayant déjà reçu un vaccin pneumococcique (tableau 7). Les réponses immunitaires étaient plus faibles chez les participants des deux groupes qui avaient déjà reçu le vaccin PPSV23.
Tableau 7. MGT de l'OPA pneumococcique
avant et 1 mois après Prevenar 20 chez les
participants âgés de 65 ans et plus ayant déjà reçu un vaccin pneumococcique (étude 1006)a,b,c,d
|
PPSV23 préalable uniquement |
Prevenar 13 préalable uniquement |
Prevenar 13 et PPSV23 préalables |
||||
|
Avant la vaccination (N = 208 - 247) |
Après la vaccination (N = 216 - 246) |
Avant la vaccination (N = 210 - 243) |
Après la vaccination (N = 201 - 243) |
Avant la vaccination (N = 106 - 121) |
Après la vaccination (N = 102 - 121) |
|
|
MGT (IC à 95 %)e |
MGT (IC à 95 %)e |
MGT (IC à 95 %)e |
MGT (IC à 95 %)e |
MGT (IC à 95 %)e |
MGT (IC à 95 %)e |
|
| Sérotype | ||||||
|
1 |
24 (20 ; 28) |
51 (42 ; 62) |
34 (28 ; 41) |
115 (96 ; 138) |
42 (32 ; 56) |
82 (61 ; 110) |
|
3 |
13 (11 ; 15) |
31 (27 ; 36) |
15 (13 ; 18) |
54 (47 ; 63) |
20 (17 ; 25) |
39 (32 ; 48) |
|
4 |
29 (23 ; 35) |
150 (118 ; 190) |
67 (53 ; 84) |
335 (274 ; 410) |
73 (53 ; 101) |
194 (143 ; 262) |
|
5 |
27 (24 ; 31) |
63 (53 ; 75) |
38 (32 ; 44) |
87 (73 ; 104) |
47 (37 ; 59) |
83 (65 ; 108) |
|
6A |
57 (46 ; 70) |
749 (577 ; 972) |
125 (99 ; 158) |
1 081 (880 ; 1 327) |
161 (116 ; 224) |
1 085 (797 ; 1 478) |
|
6B |
107 (86 ; 133) |
727 (574 ; 922) |
174 (138 ; 219) |
1 159 (951 ; 1 414) |
259 (191 ; 352) |
1 033 (755 ; 1 415) |
|
7F |
156 (132 ; 184) |
378 (316 ; 452) |
210 (175 ; 251) |
555 (467 ; 661) |
206 (164 ; 258) |
346( 277 ; 432) |
|
9V |
203 (171 ; 241) |
550 (454 ; 667) |
339 (282 ; 408) |
1 085 (893 ; 1 318) |
352 (270 ; 459) |
723 (558 ; 938) |
|
14 |
212 (166 ; 270) |
391 (315 ; 486) |
282 (224 ; 356) |
665 (554 ; 798) |
336 (238 ; 473) |
581 (434 ; 777) |
|
18C |
173 (137 ; 218) |
552 (445 ; 684) |
219 (177 ; 272) |
846 (693 ; 1 033) |
278 (209 ; 369) |
621 (470 ; 821) |
|
19A |
82 (66 ; 100) |
239 (197 ; 288) |
124 (100 ; 153) |
365 (303 ; 440) |
182 (141 ; 235) |
341 (264 ; 439) |
|
19F |
61 (52 ; 71) |
159 (131 ; 192) |
89 (74 ; 107) |
242 (199 ; 294) |
120 (94 ; 154) |
218 (168 ; 282) |
|
23F |
23 (18 ; 28) |
152 (115 ; 199) |
48 (37 ; 62) |
450 (358 ; 566) |
66 (46 ; 94) |
293 (204 ; 420) |
| Sérotypes supplémentaires | ||||||
|
8 |
55 (45 ; 67) |
212 (172 ; 261) |
28 (24 ; 33) |
603 (483 ; 753) |
139 (99 ; 195) |
294 (220 ; 392) |
|
10A |
212 (166 ; 269) |
1 012 (807 ; 1 270) |
141 (113 ; 177) |
2 005 (1 586 ; 2 536) |
400 (281 ; 568) |
1 580 (1 176 ; 2 124) |
|
11A |
510 (396 ; 656) |
1 473( 1 192 ; 1 820) |
269 (211 ; 343) |
1 908 (1 541 ; 2 362) |
550 (386 ; 785) |
1 567 (1 141 ; 2 151) |
|
12F |
147 (112 ; 193) |
1 054 (822 ; 1 353) |
53 (43 ; 65) |
1 763 (1 372 ; 2 267) |
368 (236 ; 573) |
1 401 (1 002 ; 1 960) |
|
15B |
140 (104 ; 189) |
647 (491 ; 853) |
74 (56 ; 98) |
1 480 (1 093 ; 2 003) |
190 (124 ; 291) |
1 067 (721 ; 1 578) |
|
22F |
167 (122 ; 230) |
1 773 (1 355 ; 2 320) |
60 (45 ; 82) |
4 157 (3 244 ; 5 326) |
286 (180 ; 456) |
2 718 (1 978 ; 3 733) |
|
33F |
1 129 (936 ; 1 362) |
2 02 6(1 684 ; 2 437) |
606 (507 ; 723) |
3 175 (2 579 ; 3 908) |
1 353 (1 037 ; 1 765) |
2 183 (1 639 ; 2 908) |
Abréviations
: IC = intervalle de confiance ; MGT = moyenne géométrique des titres ; LIQ =
limite inférieure de quantification ; N = nombre de participants ; OPA =
activité opsonophagocytaire ; PPSV23 = vaccin pneumococcique polyosidique
(23-valent).
a. L'étude 1006 a été menée aux États-Unis et en Suède.
b. Les résultats des tests inférieurs à la LIQ ont été fixés à 0,5 × LIQ dans l'analyse.
c. Population d'immunogénicité évaluable.
d. Administration en ouvert de Prevenar 20.
e. IC bilatéraux basés sur la distribution t de Student.
a. L'étude 1006 a été menée aux États-Unis et en Suède.
b. Les résultats des tests inférieurs à la LIQ ont été fixés à 0,5 × LIQ dans l'analyse.
c. Population d'immunogénicité évaluable.
d. Administration en ouvert de Prevenar 20.
e. IC bilatéraux basés sur la distribution t de Student.
Réponses immunitaires chez les populations particulières
Les personnes présentant les affections décrites ci-dessous présentent un risque accru de maladie pneumococcique.
Prevenar 20 n'a pas fait l'objet d'études chez les participants souffrant de drépanocytose, infectés par le VIH ou ayant subi une GCSH.
Les données issues des études cliniques menées avec Prevenar 13 (un vaccin pneumococcique conjugué composé de 13 polyosides conjugués également présents dans Prevenar 20) sont disponibles chez les enfants et les adultes présentant un risque plus élevé d'infection pneumococcique, notamment les adultes et les enfants immunodéprimés infectés par le VIH ou ayant subi une GCSH, ainsi que les enfants atteints de drépanocytose.
Les participants en bonne santé ou présentant des pathologies chroniques stables et non immunodépressives, dans tous les groupes d'âge analysés, ont présenté une réponse immunitaire plus faible avec Prevenar 20 par rapport à Prevenar 13 bien que les marges de non-infériorité prédéfinies aient été respectées. La pertinence clinique de cette observation est inconnue.
Drépanocytose
Une étude en ouvert, à bras unique, avec 2 doses de Prevenar 13 administrées à 6 mois d'intervalle a été menée chez 158 enfants et adolescents âgés de 6 à < 18 ans atteints de drépanocytose qui avaient été précédemment vaccinés avec une ou plusieurs doses de vaccin pneumococcique polyosidique 23- valent au moins 6 mois avant le recrutement. Après la première vaccination, Prevenar 13 a provoqué des taux d'anticorps mesurés à la fois par les MGC d'IgG et les MGT de l'OPA qui étaient statistiquement significativement plus élevés par rapport aux taux observés avant la vaccination. Après la deuxième dose, les réponses immunitaires étaient comparables à celles obtenues après la première dose. Un an après la deuxième dose, les taux d'anticorps mesurés par les MGC d'IgG et les MGT de l'OPA étaient plus élevés qu'avant la première dose de Prevenar 13, à l'exception des MGC d'IgG pour les sérotypes 3 et 5 qui étaient numériquement similaires.
Infection par le VIH
Enfants et adultes n'ayant jamais reçu de vaccin pneumococcique.
Dans
l'étude 6115A1-3002 (B1851021), 151 participants âgés de 6 à < 18 ans et 152
participants âgés de ≥ 18 ans infectés par le VIH (CD4 ≥ 200
cellules/µl, charge virale < 50 000 copies/mL et
absence de maladie active liée au syndrome d'immunodéficience acquise [SIDA])
et n'ayant pas reçu précédemment de vaccin pneumococcique
ont été recrutés pour recevoir 3 doses de Prevenar
13.
Conformément aux recommandations générales, une dose unique de PPSV23 a ensuite
été administrée. Les vaccins ont été administrés à 1 mois d'intervalle. Les
réponses immunitaires ont été évaluées chez 128 à 133 participants évaluables
âgés de 6 à < 18 ans et chez 131 à 137 participants évaluables âgés de ≥
18 ans environ 1 mois après chaque dose du vaccin. Après l'administration de la
première dose, Prevenar 13 a induit des taux
d'anticorps, mesurés par les MGC d'IgG et les MGT de
l'OPA, qui étaient statistiquement significativement plus élevés que les taux
avant la vaccination.
Après l'administration de la deuxième et de la troisième dose de Prevenar 13, les réponses immunitaires étaient similaires
ou supérieures à celles observées après l'administration de la première dose.
Adultes précédemment vaccinés avec PPSV23
Dans l'étude 6115A1-3017 (B1851028), les réponses immunitaires ont été évaluées chez 329 participants infectés par le VIH âgés de ≥ 18 ans (nombre de lymphocytes T CD4+ ≥ 200 cellules/µL et charge virale < 50 000 copies/mL) précédemment vaccinés avec PPSV23 administré au moins 6 mois avant le recrutement. Les participants ont reçu 3 doses de Prevenar 13 : lors du recrutement, 6 mois et 12 mois après l'administration de la première dose de Prevenar 13. Après la première vaccination, Prevenar 13 a induit des taux d'anticorps, mesurés par les MGC d'IgG et les MGT de l'OPA, qui étaient statistiquement significativement plus élevés que les taux avant la vaccination. Après l'administration de la deuxième et de la troisième dose de Prevenar 13, les réponses immunitaires étaient comparables ou supérieures à celles observées après l'administration de la première dose. Les participants ayant déjà reçu 2 doses ou plus de PPSV23 ont présenté une réponse immunitaire similaire à celle des participants ayant déjà reçu une seule dose.
Greffe de cellules souches hématopoïétiques (GCSH)
Dans l'étude 6115A1-3003 (B1851022), 61 participants âgés de 2 à < 18 ans et 190 participants âgés de ≥ 18 ans ayant subi une GCSH allogénique ont été recrutés pour recevoir 3 doses de Prevenar 13 avec un intervalle d'au moins 1 mois entre les doses. La première dose a été administrée entre 3 et 6 mois après la GCSH. Une quatrième dose (de rappel) de Prevenar 13 a été administrée 6 mois après l'administration de la troisième dose. Conformément aux recommandations générales, une dose unique de PPSV23 a été administrée 1 mois après l'administration de la quatrième dose de Prevenar 13. Les réponses immunitaires, mesurées par les MGC d'IgG, ont été évaluées chez 41 à 52 participants évaluables âgés de 2 à < 18 ans et chez 127 à 159 participants évaluables âgés de ≥ 18 ans environ 1 mois après la vaccination. Prevenar 13 a provoqué une augmentation des taux d'anticorps après chaque dose. Les réponses immunitaires après l'administration de la quatrième dose de Prevenar 13 étaient significativement plus élevées pour tous les sérotypes par rapport à celles de la troisième dose, à l'exception du sérotype 3 dans le groupe d'âge de 2 à < 18 ans. Dans l'ensemble, les participants âgés de 2 à < 18 ans présentaient des réponses immunitaires spécifiques au sérotype généralement plus élevées que les participants âgés de ≥ 18 ans.
Cette étude a démontré que 4 doses de Prevenar 13 provoquaient des concentrations sériques d'IgG similaires à celles induites par une dose unique chez des participants sains du même groupe d'âge.
Maladie pneumococcique invasive (MPI)
L'efficacité vaccinale de Prevenar 13 contre les MPI causées par des sérotypes contenus dans le vaccin a été évaluée dans le cadre de l'étude SpIDnet, un projet de surveillance renforcée des MPI dans plusieurs pays d'Europe. D'après les données recueillies sur une période de 6 ans (2012 - 2018) dans 10 centres de 7 pays européens utilisant Prevenar 13, l'efficacité contre les MPI causées par les sérotypes contenus dans le vaccin chez les enfants âgés de < 5 ans était de 84,2 % (IC à 95 % : 79,0 - 88,1) et de 88,7 % (IC à 95 % : 81,7 - 92,7) chez les enfants recevant ≥ 1 dose de Prevenar 13 et un schéma vaccinal complet, respectivement.
Sans objet.
Prevenar 20 n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines. Néanmoins, certains des effets mentionnés dans la rubrique Effets indésirables peuvent affecter temporairement l'aptitude à conduire des véhicules ou à utiliser des machines.
Les données non cliniques issues des études conventionnelles de toxicité après administrations répétées et des fonctions de la reproduction et du développement n'ont pas révélé de risque particulier pour l'homme.
Pendant la conservation, un dépôt de couleur blanche et un surnageant clair peuvent être observés dans la seringue préremplie contenant la suspension. Les seringues préremplies doivent être conservées horizontalement afin de réduire le temps de remise en suspension.
Préparation à l'administration
|
Étape 1.
Remise en suspension du vaccin
Tenir la seringue préremplie horizontalement entre le pouce et l'index et agiter vigoureusement jusqu'à ce que le contenu de la seringue devienne une suspension blanche homogène. Ne pas utiliser le vaccin s'il ne peut pas être remis en suspension. |
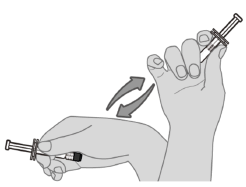 |
|
Étape 2.
Inspection visuelle
Inspecter visuellement le vaccin pour vérifier l'absence de grosses particules et de décoloration avant l'administration. Ne pas utiliser si de grosses particules ou une décoloration sont détectées. Si le vaccin n'est pas une suspension blanche homogène, répéter les étapes 1 et 2. |
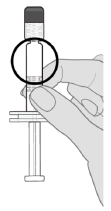 |
|
Étape 3.
Retrait du capuchon de la seringue
Retirer le capuchon de la seringue de l'adaptateur Luer lock en tournant lentement le capuchon dans le sens inverse des aiguilles d'une montre tout en tenant l'adaptateur Luer lock. Remarque : veiller à ce que la tige de piston étendu ne soit pas enfoncée lors du retrait du capuchon de la seringue. |
 |
|
Étape 4.
Fixation d'une aiguille stérile
Fixer une aiguille adaptée à l'administration intramusculaire à la seringue préremplie en tenant l'adaptateur Luer lock et en tournant l'aiguille dans le sens des aiguilles d'une montre. |
|
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I.
Non remboursable et non agréé aux collectivités à la date du 11 mars 2024 dans l’indication « Immunisation active pour la prévention des maladies invasives, des pneumonies et des otites moyennes aiguës causées par Streptococcus pneumoniae chez les nourrissons, les enfants et les adolescents âgés de 6 semaines à moins de 18 ans. Demande d’admission à l’étude.
Remboursement en fonction de l'indication (JO du 07/03/2024) :
La seule indication thérapeutique ouvrant droit à la prise en charge ou
au remboursement par l'assurance maladie est l'immunisation active pour
la prévention des maladies invasives et des pneumonies causées par
Streptococcus pneumoniae chez les personnes âgées de 18 ans et plus,
selon les recommandations en vigueur de la HAS datant du 27 juillet
2023.
Suspension injectable.
Le vaccin se présente sous la forme d'une suspension blanche homogène.
0,5 mL de suspension injectable dans une seringue préremplie (verre de type I) avec un capuchon d'embout (mélange de caoutchouc synthétique isoprène/bromobutyle) et un bouchon-piston (caoutchouc chlorobutyle).
Conditionnement de 1 seringue préremplie, avec aiguille.
Une dose (0,5 mL) contient :
|
Polyoside pneumococcique sérotype 11,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 31,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 41,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 51,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 6A1,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 6B1,2 |
4,4 µg |
|
Polyoside pneumococcique sérotype 7F1,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 81,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 9V1,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 10A1,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 11A1,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 12F1,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 141,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 15B1,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 18C1,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 19A1,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 19F1,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 22F1,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 23F1,2 |
2,2 µg |
|
Polyoside pneumococcique sérotype 33F1,2 |
2,2 µg |
1 Conjugué à la protéine
vectrice CRM197 (environ 51 µg par dose)
2 Adsorbé sur
phosphate d'aluminium (0,125 mg d'aluminium par dose)
Excipients à effet notoire :
Prevenar 20 contient 0,1 mg de polysorbate 80 par dose de 0,5 mL, équivalant à 0,2 mg/mL de polysorbate 80.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Chlorure de sodium
Acide succinique
Polysorbate 80
Eau pour préparations injectables
Pour l'adjuvant, voir rubrique COMPOSITION QUALITATIVE ET QUANTITATIVE.
