EMGALITY 120 mg, solution injectable en stylo pré-rempli, boîte de 1 stylo prérempli de 1 mL
Dernière révision : 25/03/2024
Taux de TVA : 2.1%
Laboratoire exploitant : ORGANON FRANCE
Emgality est indiqué dans la prophylaxie de la migraine chez l'adulte ayant au moins 4 jours de migraine par mois.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Risque cardiovasculaire
Les patients ayant certaines maladies cardiovasculaires sévères ont été exclus des études cliniques (voir rubrique Propriétés pharmacodynamiques). Aucune donnée de sécurité n'est disponible chez ces patients.
Hypersensibilité grave
Des réactions graves d'hypersensibilité, comprenant des cas d'anaphylaxie, d’angiœdème et d'urticaire, ont été rapportées (voir rubrique Effets indésirables). Les réactions graves d'hypersensibilité peuvent survenir le 1er jour suivant l'administration de galcanézumab, toutefois des cas d'apparition tardive (survenant au-delà d'1 jour et jusqu'à 4 semaines après l'administration) ont été rapportés. Dans certains cas, les réactions d'hypersensibilité avaient une durée prolongée. En cas de réaction d'hypersensibilité grave, l'administration du galcanézumab doit être immédiatement arrêtée et un traitement approprié doit être instauré (voir rubrique Contre-indications). Les patients doivent être informés de la possibilité de l'apparition tardive d'une réaction d'hypersensibilité et du fait qu'ils doivent contacter leur médecin.
Excipients
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose de 120 mg, c'est-à-dire qu'il est essentiellement « sans sodium ».
Résumé du profil de sécurité
Plus de 2 500 patients ont été exposés au galcanézumab dans les études cliniques sur la prophylaxie de la migraine utilisées lors de l'enregistrement initial du galcanézumab. Plus de 1 400 patients ont été exposés au galcanézumab dans la phase en double-aveugle des études de phase 3 contrôlées versus placebo. 279 patients ont été exposés pendant 12 mois.
Les effets indésirables reportés pour les doses de 120 et 240 mg au cours des études cliniques sur la migraine ont été : douleur au site d'injection (10,1 %/11,6 %), réactions au site d'injection (9,9 %/14,5 %), vertiges (0,7 %/1,2 %), constipation (1,0 %/1,5 %), prurit (0,7 %/1,2 %) et urticaire (0,3 %/0,1 %). La plupart des effets étaient d'intensité légère ou modérée. Moins de 2,5 % des patients inclus dans ces études ont arrêté en raison d'effets indésirables.
Liste tabulée des effets indésirables
Tableau 1. Liste des effets indésirables issus des études cliniques et rapportés en post- commercialisation
Estimation
de la fréquence : Très fréquent (≥ 1/10), fréquent (≥ 1/100,
< 1/10), peu fréquent (≥ 1/1 000, < 1/100),
rare (≥ 1/10 000, < 1/1 000).
| Classe de systèmes d'organes | Très fréquent | Fréquent | Peu fréquent | Rare |
| Affections du système immunitaire | Anaphylaxie Angioœdème | |||
| Affections de l'oreille et du labyrinthe | Vertiges | |||
| Affections gastro- intestinales | Constipation | |||
| Affections de la peau et du tissu sous-cutané | Prurit Rash | Urticaire | ||
| Troubles généraux et anomalies au site d'administration | Douleur au site d'injection Réaction au site d'injectiona |
a
Les termes les plus fréquemment rapportés (≥ 1 %) ont été : réaction au
site d'injection, érythème au site d'injection, prurit au site
d'injection, ecchymose au site d'injection, gonflement au site
d'injection.
Description d'effets indésirables sélectionnés
Douleur ou réactions au site d'injection
La
majorité des réactions liées au site d'injection ont été d'intensité
légère à modérée et moins de 0,5 % des patients exposés au galcanézumab
au cours des études de phase 3 ont interrompu le traitement en raison
d'une réaction au site d'injection. La majorité de ces réactions au
site d'injection a été rapportée le premier jour de traitement et a
disparu dans un délai moyen de 5 jours. Chez 86 % des patients ayant
signalé une douleur au site d'injection, la réaction est survenue dans
l'heure suivant l'injection et a disparu dans un délai moyen d'1 jour.
1 % des patients exposés au galcanézumab au cours des études de phase 3
ont présenté une douleur intense au site d'injection.
Urticaire
Bien
que les cas d'urticaire soient peu fréquents, des cas graves ont été
rapportés dans des études cliniques avec le galcanézumab.
Immunogénicité
Dans
les études cliniques, l'incidence du développement d'anticorps
anti-galcanézumab pendant la phase de traitement en double aveugle
était de 4,8 % parmi les patients recevant une injection de
galcanézumab par mois (tous sauf un avaient une activité neutralisante in vitro).
Après 12 mois de traitement, jusqu'à 12,5 % des patients traités par le
galcanézumab ont développé des anticorps anti- galcanézumab à des
titres faibles et ont présenté une activité neutralisante in vitro dans
la majorité des cas. Toutefois, la présence d'anticorps
anti-galcanézumab n'a pas eu d'incidence sur la pharmacocinétique,
l'efficacité ou la sécurité d'emploi du galcanézumab.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance. Site internet : https://signalement.social-sante.gouv.fr.
Evaluation
du bénéfice du traitement dans les 3 mois qui suivent l'instauration
puis évaluation régulière de la réponse clinique.
INFORMER les patients de la possibilité de l'apparition tardive d'une
réaction d'hypersensibilité et du fait qu'ils doivent contacter leur
médecin.
CONTACTER UN MEDECIN ou demander immédiatement une aide médicale d'urgence en cas de :
- Difficultés pour respirer ou avaler.
- Tension artérielle basse, pouvant conduire à une sensation de vertiges ou à de légers
étourdissements.
- Gonflement du cou, du visage, de la bouche, des lèvres, de la langue ou de la gorge pouvant
rapidement se développer.
- Démangeaisons sévères de la peau avec une éruption cutanée rouge ou des boutons.
PRUDENCE en cas de conduite de véhicules ou d'utilisation de machines (vertiges).
Grossesse
Les données sur l'utilisation du galcanézumab chez la femme enceinte sont limitées. Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects sur la reproduction (voir rubrique Données de sécurité préclinique). L'immunoglobuline humaine (IgG) traverse la barrière placentaire. Par précaution, il est préférable d'éviter l'administration du galcanézumab pendant la grossesse.
Allaitement
On ne sait pas si le galcanézumab est excrété dans le lait maternel. Les IgG humaines sont excrétées dans le lait maternel au cours des premiers jours suivant la naissance et leur concentration décroit rapidement par la suite. Par conséquent, un risque pour l'enfant allaité ne peut être exclu durant cette courte période. Par la suite, l'utilisation du galcanézumab pendant l'allaitement pourra être envisagée seulement en cas de besoin clinique.
Fertilité
L'effet du galcanézumab sur la fertilité humaine n'a pas été évalué. Les études réalisées chez l'animal n'ont pas mis en évidence d'effets délétères sur la fertilité des mâles et des femelles (voir rubrique Données de sécurité préclinique).
Aucune étude d'interaction médicamenteuse n'a été réalisée.
Aucune interaction pharmacocinétique n'est attendue en raison des caractéristiques du galcanézumab.
Le traitement doit être instauré par des médecins expérimentés dans le diagnostic et le traitement de la migraine.
Posologie
La posologie recommandée est de 120 mg de galcanézumab en injection sous-cutanée une fois par mois, avec une dose de charge de 240 mg à l'initiation.
En cas d'oubli d'administration d'une dose de galcanézumab, le patient doit s'injecter la dose oubliée dès que possible et reprendre ensuite l'administration mensuelle.
Le bénéfice du traitement doit être évalué dans les 3 mois qui suivent l'instauration du traitement. Toute décision de poursuivre le traitement doit être prise au cas par cas. Par la suite, une évaluation régulière de la réponse clinique au traitement est recommandée.
Personnes âgées (≥ 65 ans)
Les
informations chez les personnes âgées de 65 ans et plus sont limitées.
Aucune adaptation posologique n'est requise étant donné que la
pharmacocinétique du galcanézumab n'est pas affectée par l'âge.
Insuffisance rénale/insuffisance hépatique
Aucun
ajustement posologique n'est nécessaire chez les patients atteints
d'insuffisance rénale légère à modérée ou d'insuffisance hépatique
(voir rubrique Propriétés pharmacocinétiques).
Population pédiatrique
La
sécurité et l'efficacité du galcanézumab chez les enfants âgés de 6 à
18 ans n'ont pas encore été établies. Aucune donnée n'est disponible.
Il n'existe pas d'utilisation justifiée du galcanézumab chez les enfants âgés de moins de 6 ans dans la prévention de la migraine.
Mode d'administration
Voie sous-cutanée.
Un patient peut s'injecter lui-même le galcanézumab en suivant les instructions d'utilisation. Le galcanézumab doit être injecté par voie sous-cutanée dans l'abdomen, la cuisse, l'arrière du bras ou dans le fessier. Après une formation, les patients peuvent s'injecter eux-mêmes le galcanézumab si un professionnel de santé estime que cela est approprié. Des instructions complètes sur l'administration sont données dans la notice de l'utilisateur.
Durée de conservation :
2 ans.
Précautions particulières de conservation :
Conserver au réfrigérateur (2ºC-8ºC). Ne pas congeler.
Conserver dans l'emballage d'origine à l'abri de la lumière.
Emgality peut être conservé en dehors du réfrigérateur pendant une période maximale de 7 jours à des températures ne dépassant pas 30°C. Si ces conditions sont dépassées, le stylo pré-rempli doit être jeté.
Sans objet.
Chez l'homme, des doses allant jusqu'à 600 mg ont été administrées par voie sous-cutanée sans toxicité dose-limitante. En cas de surdosage, il est recommandé de surveiller le patient afin de détecter les signes ou symptômes d'effets indésirables et d'instaurer immédiatement un traitement symptomatique approprié.
Classe pharmacothérapeutique : Analgésiques, antagonistes du peptide relié au gène de la calcitonine (CGRP), Code ATC : N02CD02
Mécanisme d'action
Le galcanézumab est un anticorps monoclonal IgG4 humanisé qui se lie au peptide relié au gène de la calcitonine (CGRP) et empêche ainsi son activité biologique. Des concentrations sanguines élevées de CGRP ont été associées à la crise de migraine. Le galcanézumab se lie au CGRP avec une forte affinité (KD = 31 pM) et avec une spécificité élevée (> 10 000 fois vs peptides apparentés tels que l'adrénomédulline, l'amyline, la calcitonine et l'intermédine).
Efficacité et sécurité cliniques
L'efficacité et la sécurité du galcanézumab ont été évaluées dans trois études de phase 3, randomisées, contrôlées versus placebo, en double aveugle chez des patients adultes (N = 2 886). Les 2 études sur la migraine épisodique (EVOLVE-1 et EVOLVE-2) ont inclus des patients qui répondaient aux critères de diagnostic de migraine avec ou sans aura selon la classification internationale des céphalées (International Classification of HeadacheDisorders, ICHD), avec 4 à 14 jours de migraine par mois. L'étude sur la migraine chronique (REGAIN) a inclus des patients qui répondaient aux critères ICHD de migraine chronique avec ≥ 15 jours de céphalées par mois, dont au moins 8 jours avec les caractéristiques d'une migraine. Les patients ayant présenté un événement cardiovasculaire aigu récent (y compris infarctus du myocarde, angor instable, pontage coronarien, accident vasculaire cérébral, thrombose veineuse profonde) et/ou ceux considérés comme présentant un risque cardiovasculaire grave ont été exclus des études cliniques évaluant le galcanézumab. Les patients d'âge > 65 ans ont également été exclus.
Les patients ont reçu le placebo, le galcanézumab à 120 mg/mois (avec une dose de charge initiale de 240 mg à l'initiation) ou le galcanézumab à 240 mg/mois et ont été autorisés à prendre un traitement de la crise de migraine. Dans les trois études, les patients étaient principalement des femmes (> 83 %) avec un âge moyen de 41 ans et des antécédents de migraine sur une durée moyenne de 20 à 21 ans. Dans l'ensemble des études, environ un tiers des patients étaient en échec d'au moins un traitement prophylactique antérieur en raison d'un manque d'efficacité et environ 16 % des patients étaient en échec d'au moins deux traitements prophylactiques antérieurs en raison d'un manque d'efficacité.
Dans les 3 études, le critère principal d'efficacité était la variation moyenne du nombre de jours de migraine par mois (NJMM) par rapport aux valeurs initiales. Le taux de réponse est le pourcentage moyen de patients atteignant un seuil défini en termes de réduction du nombre de jours de migraine mensuel (≥ 50 %, ≥ 75 % et 100 %) pendant toute la durée de la période de traitement en double aveugle. L'impact de la migraine sur le fonctionnement a été évalué par la mesure de la fonction restrictive (RR) du score du questionnaire de qualité de vie spécifique à la migraine (MSQ) version 2.1 et par le questionnaire d'évaluation du handicap lié à la migraine (MIDAS). Le MSQ mesure l'impact de la migraine sur les activités professionnelles ou quotidiennes, les relations avec la famille et les amis, les loisirs, la productivité, la concentration, l'énergie et la fatigue. Le score varie de 0 à 100, les scores plus élevés indiquant moins de handicap, c'est-à-dire que les patients subissent moins de restrictions sur l'exécution des activités quotidiennes. Pour le MIDAS, les scores les plus élevés indiquent un plus grand handicap. Les scores à l'inclusion du questionnaire d'évaluation du handicap lié à la migraine (MIDAS) reflétaient un handicap lié à la migraine sévère chez les patients des études EVOLVE-1 et EVOLVE-2 (moyenne de 33,1), ainsi qu'une population très sévèrement handicapée par la migraine (moyenne de 67,2) dans l'étude REGAIN.
Migraine épisodique
Les études EVOLVE-1 et EVOLVE-2 comportaient une période de traitement de 6
mois, en double aveugle, contrôlée versus placebo. Le taux de patients
traités par galcanézumab ayant terminé l'étude en
double aveugle était compris entre 82,8 % et 87,7 %.
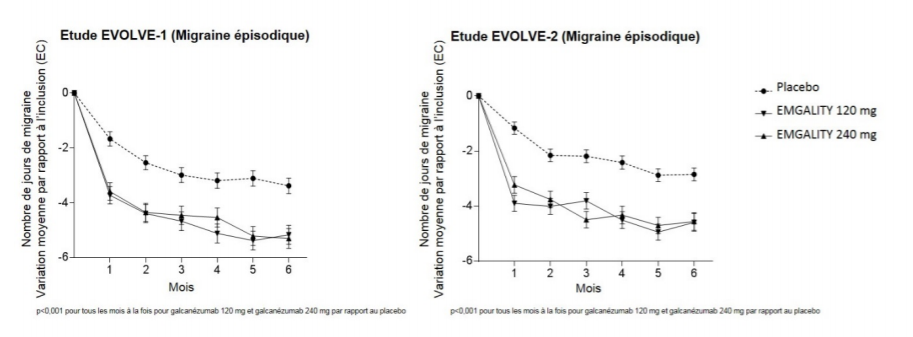
Les deux groupes de traitement recevant 120 mg et 240 mg de galcanézumab ont montré des améliorations statistiquement significatives et cliniquement pertinentes de la variation moyenne du nombre de jours de migraine par mois par rapport aux valeurs initiales comparativement au groupe placebo (voir tableau 2). Les patients traités par galcanézumab avaient des taux de réponse plus élevés et des réductions plus importantes du nombre de jours de migraine mensuel qui ont nécessité un traitement de la crise de migraine par rapport aux patients sous placebo. Les patients traités par galcanézumab ont présenté une amélioration plus importante du fonctionnement (telle que mesurée par le score du questionnaire MSQ mesurant la fonction restrictive) dès le premier mois de traitement comparativement aux patients sous placebo. Une proportion plus élevée de patients traités par galcanézumab ont atteint des niveaux cliniquement significatifs d'amélioration du fonctionnement (taux de répondeurs selon le score du questionnaire MSQ mesurant la fonction restrictive) par rapport à ceux traités par placebo. Le galcanézumab a été associé à une réduction statistiquement significative du handicap par rapport au placebo.
Comparativement aux patients sous placebo, les patients traités par galcanézumab à 120 mg ou à 240 mg ont présenté des diminutions moyennes significativement plus importantes par rapport aux valeurs initiales du nombre de jours de migraine mensuel au 1er mois et à tous les mois suivants jusqu'au 6ème mois (voir figure 1). De plus, au 1er mois, les patients traités par galcanézumab (dose de charge de 240 mg) ont présenté un nombre significativement moindre de jours de migraine hebdomadaires que les patients sous placebo, à la semaine 1 et à chaque semaine suivante.
Figure 1 Réduction des jours de migraine mensuels au fil du
temps dans les études EVOLVE-1
et EVOLVE-2
Tableau 2. Résultats d'efficacité et mesures des résultats rapportés par le patient
|
| EVOLVE 1 -
Migraine épisodique
|
EVOLVE 2 -Migraine épisodique | ||||
|
| Emgality |
Placebo
|
Emgality
|
Placebo | ||
| 120 mg | 240 mg | 120 mg | 240 mg | |||
| N = 210 | N = 208 | N = 425 | N = 226 | N = 220 | N = 450 | |
| Résultats d'efficacitéa | ||||||
| NJMM | ||||||
| Valeur initiale | 9,21 | 9,14 | 9,08 | 9,07 | 9,06 | 9,19 |
| Variation moyenne | -4,73 | -4,57 | -2,81 | -4,29 | -4,18 | -2,28 |
|
Différence entre les traitements
|
-1,92 | -1,76 | -2,02 | -1,90 | ||
|
IC95 % |
(-2,48 ; -1,37) | (-2,31 ;-1,20) | (-2,55 ;-1,48) | (-2,44 ; -1,36) | ||
| Valeur de p | <0,001d | <0,001d | <0,001d | <0,001d | ||
| Répondeurs ≥50 % NJMM | ||||||
| Pourcentage, % | 62,3 | 60,9 | 38,6 | 59,3 | 56,5 | 36,0 |
| Valeur de p | <0,001d | <0,001d | <0,001d | <0,001d | ||
| Répondeurs ≥75 % NJMM | ||||||
| Pourcentage, % | 38,8 | 38,5 | 19,3 | 33,5 | 34,3 | 17,8 |
| Valeur de p | <0,001d | <0,001d | <0,001d | <0,001d | ||
| Répondeurs à 100 % NJMM | ||||||
| Pourcentage, % | 15,6 | 14,6 | 6,2 | 11,5 | 13,8 | 5,7 |
| Valeur de p | <0,001d | <0,001d | <0,001d | <0,001d | ||
|
NJMM avec médicament pour la crise |
||||||
| Valeur initiale | 7,42 | 7,34 | 7,38 | 7,47 | 7,47 | 7,62 |
| Variation moyenne | -3,96 | -3,76 | -2,15 | -3,67 | -3,63 | -1,85 |
|
|
-1,81 | -1,61 | -1,82 | -1,78 | ||
| IC95 % | (-2,28 ; -1,33) | (-2,09 ;-1,14) | (-2,29 ; -1,36) | (-2,25 ; -1,31) | ||
| Valeur de p | <0,001d | <0,001d | <0,001d | <0,001d | ||
| Mesures des résultats rapportés par le patient | ||||||
|
Score du questionnaire MSQ mesurant la fonction restrictiveb |
||||||
| N | 189 | 184 | 377 | 213 | 210 | 396 |
| Valeur initiale | 51,39 | 48,76 | 52,92 | 52,47 | 51,71 | 51,35 |
| Variation moyenne | 32,43 | 32,09 | 24,69 | 28,47 | 27,04 | 19,65 |
|
|
7,74 | 7,40 | 8,82 | 7,39 | ||
| IC95 % | (5,20 ; 10,28) | (4,83 ; 9,97) | (6,33 ; 11,31) | (4,88 ; 9,90) | ||
| Valeur de p | <0,001d | <0,001d | <0,001d | <0,001d | ||
|
Répondeurs selon le score du questionnaire MSQ mesurant la fonction restrictivec |
||||||
| N | 189 | 184 | 377 | 213 | 210 | 396 |
| Pourcentage, % | 63,5 | 69,6 | 47,2 | 58,2 | 60,0 | 43,4 |
| Valeur de p | <0,001f | <0,001f | <0,001f | <0,001f | ||
| Score total MIDASe | ||||||
| N | 177 | 170 | 345 | 202 | 194 | 374 |
| Valeur initiale | 32,93 | 36,09 | 31,84 | 30,87 | 32,75 | 34,25 |
| Variation moyenne | -21,16 | -20,06 | -14,87 | -21,17 | -20,24 | -12,02 |
| Différence entre les traitements | -6,29 | -5,19 | -9,15 | -8,22 | ||
| IC95 % | (-9,45 ; -3,13) | (-8,39 ;-1,98) | (-12,61 ; -5,69) | (-11,71 ; -4,72) | ||
| Valeur de p | <0,001f | 0,002f | <0,001f | <0,001f | ||
N
= nombre de patients ; IC95 % = intervalle de confiance à 95 %.
aLes résultats d'efficacité ont été évalués du 1er au 6ème mois.
bEvalués du 4ème mois au 6ème mois.
cDéfinis comme ceux ayant une amélioration ≥ 25 points en moyenne pour la migraine épisodique du 4ème mois au 6ème mois.
dStatistiquement significatif après ajustement pour comparaisons multiples.
eEvalué au 6ème mois.
fNonadjusté pour comparaisons multiples.
aLes résultats d'efficacité ont été évalués du 1er au 6ème mois.
bEvalués du 4ème mois au 6ème mois.
cDéfinis comme ceux ayant une amélioration ≥ 25 points en moyenne pour la migraine épisodique du 4ème mois au 6ème mois.
dStatistiquement significatif après ajustement pour comparaisons multiples.
eEvalué au 6ème mois.
fNonadjusté pour comparaisons multiples.
Dans les données consolidées des études EVOLVE-1 et EVOLVE-2, chez les patients en échec d'un ou plusieurs traitements prophylactiques pour des raisons d'efficacité, la différence entre les traitements sur la réduction du nombre moyen de jours de migraine par mois observé était de -2,69 jours (p < 0,001) entre le galcanézumab à 120 mg et le placebo et de -2,78 jours (p < 0,001) entre le galcanézumab à 240 mg et le placebo. Chez les patients en échec de deux ou plusieurs traitements prophylactiques, la différence entre les traitements était de -2,64 jours (p < 0,001) entre le galcanézumab à 120 mg et le placebo et de -3,04 jours (p < 0,001) entre le galcanézumab à 240 mg et le placebo.
Migraine chronique
L'étude REGAIN comportait une période de
traitement de 3 mois, en double aveugle, contrôlée versus placebo,
suivie d'une période d'extension en ouvert de 9 mois. Environ 15 % des patients
ont poursuivi un traitement concomitant par topiramate ou propranolol,
conformément au protocole de prophylaxie de la migraine. Le taux de patients
traités par galcanézumab ayant terminé l'étude en
double aveugle était de 95,3 %.
Les deux groupes de traitement avec galcanézumab à 120 mg et à 240 mg ont montré des améliorations statistiquement significatives et cliniquement pertinentes de la variation moyenne du nombre de jours de migraine par rapport aux valeurs initiales comparativement au groupe placebo (voir tableau 3). Les patients traités par galcanézumab avaient des taux de réponse plus élevés et des réductions plus importantes du nombre de jours de migraine mensuel qui ont nécessité un traitement de la crise par rapport aux patients sous placebo. Les patients traités par galcanézumab ont présenté une amélioration plus grande du fonctionnement (telle que mesurée par le score du questionnaire MSQ mesurant la fonction restrictive) dès le premier mois de traitement comparativement aux patients sous placebo. Une proportion plus élevée de patients traités par galcanézumab ont atteint des niveaux cliniquement significatifs d'amélioration du fonctionnement (taux de répondeurs selon le score du questionnaire MSQ mesurant la fonction restrictive) par rapport à ceux traités par placebo. Le galcanézumab à la dose de 120 mg a été associé à une réduction statistiquement significative du handicap par rapport au placebo.
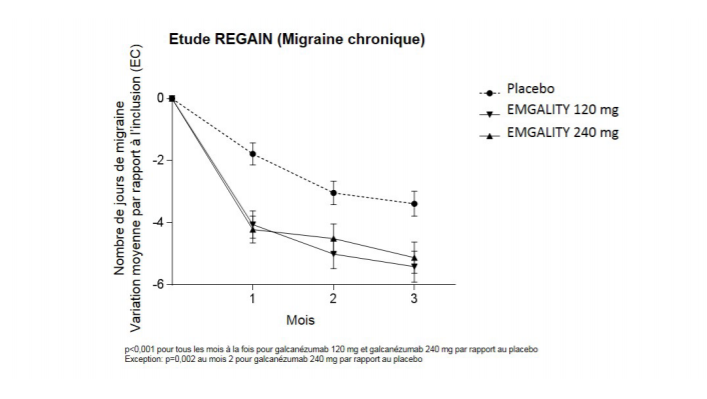
Comparativement aux patients sous placebo, les patients traités par galcanézumab à 120 mg ou à 240 mg ont présenté des diminutions moyennes significativement plus grandes par rapport aux valeurs initiales du nombre de jours de migraine mensuel au 1er mois et à tous les mois suivants jusqu'au 3ème mois (voir figure 2). De plus, au 1er mois, les patients traités par galcanézumab (dose de charge de 240 mg) ont présenté un nombre significativement moindre de jours de migraine hebdomadaires que les patients sous placebo, à la semaine 1 et à chaque semaine suivante.
Figure 2 Réduction des jours de migraine mensuels au fil du temps dans l'étude REGAIN
Tableau 3. Résultats d'efficacité et mesures des résultats rapportés par le patient
|
REGAIN - Migraine chronique
|
|||
| Emgality | Placebo | ||
| 120 mg | 240 mg | ||
| N = 273 | N = 274 | N = 538 | |
| Résultats d'efficacitéa | |||
| NJMM | |||
| Valeur initiale | 19,36 | 19,17 | 19,55 |
| Variation moyenne | -4,83 | -4,62 | -2,74 |
| Différence de traitement | -2,09 | -1,88 | |
| IC95 % | (-2,92 ; -1,26) | (-2,71 ; -1,05) | |
| Valeur de p | <0,001c | <0,001c | |
| Répondeurs ≥50 % NJMM | |||
| Pourcentage, % | 27,6 | 27,5 | 15,4 |
| Valeur de p | <0,001c | <0,001c | |
| Répondeurs ≥75 % NJMM | |||
| Pourcentage, % | 7,0 | 8,8 | 4,5 |
| Valeur de p | 0,031d | <0,001c | |
| Répondeurs à 100 % NJMM | |||
| Pourcentage, % | 0,7 | 1,3 | 0,5 |
| Valeur de p | >0,05d | >0,05d | |
| NJMM avec médicament pour la crise | |||
| Valeur initiale | 15,12 | 14,49 | 15,51 |
| Variation moyenne | -4,74 | -4,25 | -2,23 |
| Différence de traitement | -2,51 | -2,01 | |
| IC95 % | (-3,27 ; -1,76) | (-2,77 ; -1,26) | |
| Valeur de p | <0,001d | <0,001 c | |
|
Mesures des résultats rapportés par le patient b | - |
- |
- |
|
Score du questionnaire MSQ mesurant la fonction restrictive |
|||
| N | 252 | 253 | 494 |
| Valeur initiale | 39,29 | 38,93 | 38,37 |
| Variation moyenne | 21,81 | 23,05 | 16,76 |
| Différence de traitement | 5,06 | 6,29 | |
| IC95 % | (2,12 ; 7,99) | (3,03 ; 9,55) | |
| Valeur de p | <0,001d | <0,001c | |
|
Répondeurs selon le score du questionnaire MSQ mesurant la fonction restrictive |
|||
| N | 252 | 253 | 494 |
| Pourcentage, % | 64,3 | 64,8 | 54,1 |
| Valeur de p | 0,003e | 0,002e | |
| Score total MIDAS | |||
| N | 254 | 258 | 504 |
| Valeur initiale | 62,46 | 69,17 | 68,66 |
| Variation moyenne | -20,27 | -17,02 | -11,53 |
| Différence de traitement | -8,74 | -5,49 | |
| IC95 % | (-16,39 ; -1,08) | (-13,10 ; 2,12) | |
| Valeur de p | 0,025e | >0,05e | |
aLes résultats d'efficacité ont été évalués du 1er au 3ème mois.
bLes résultats rapportés par le patient ont été évalués au 3ème mois. Les répondeurs selon le score du questionnaire MSQ mesurant la fonction restrictive ont été définis comme ceux ayant une amélioration ≥ 17,14 points pour la migraine chronique au 3ème mois.
cStatistiquement significatif après ajustement pour comparaisons multiples.
dNon statistiquement significatif après ajustement pour comparaisons multiples.
eNonadjusté pour comparaisons multiples.
Chez les patients en échec d'un ou plusieurs traitements prophylactiques pour des raisons d'efficacité, la différence de traitement sur la réduction du nombre moyen de jours de migraine par mois observé était de -3,54 jours (p < 0,001) entre le galcanézumab à 120 mg et le placebo et de -1,37 jours (p < 0,05) entre le galcanézumab à 240 mg et le placebo. Chez les patients en échec de deux ou plusieurs traitements prophylactiques, la différence de traitement était de -4,48 jours (p < 0,001) entre le galcanézumab à 120 mg et le placebo et de -1,86 jours (p < 0,001) entre le galcanézumab à 240 mg et le placebo.
Soixante-quatre pour cent étaient en situation de surconsommation médicamenteuse contre les crises de céphalées aiguës à l'inclusion. Chez ces patients, la différence de traitement sur la réduction du nombre de jours de migraine par mois observé était de -2,53 jours (p < 0,001) entre le galcanézumab à 120 mg et le placebo et de -2,26 jours (p < 0,001) entre le galcanézumab à 240 mg et le placebo.
Efficacité à long terme
L'efficacité
était maintenue durant 1
an dans une étude ouverte dans laquelle les patients ayant des
migraines
épisodique ou chronique (avec une moyenne de 10,6 jours de migraine par
mois à
l'inclusion) ont été traités par galcanézumab à 120
mg/mois (avec une dose initiale de charge à 240 mg pour le premier
mois) ou galcanézumab à 240 mg/mois. 77,8 % des patients ont terminé
la période de traitement. La réduction globale moyenne du nombre de
jours de
migraine par mois, sur la phase de traitement, était de 5,6 jours pour
le
groupe à la dose à 120 mg et de 6,5 jours pour le groupe à la dose à
240 mg.
Plus de 72 % de patients ayant terminé l'étude ont rapporté une
réduction de 50
% du nombre de jours de migraine au 12ème mois. Dans les données
consolidées
des études EVOLVE-1 et EVOLVE-2, plus de 19 % des patients traités par
galcanézumab présentent une réponse du NJMM ≥ 50 % du
1er au 6ème mois versus 8 % des patients sous placebo (p < 0,001).
Etude clinique de phase 3 réalisée dans une population
préalablement en échec de 2 à 4 catégories de traitements prophylactiques de la
migraine
L'étude clinique CONQUER, menée chez des patients atteints de migraine
chronique ou épisodique, préalablement en échec de 2 à 4 catégories de
traitements prophylactiques durant les 10 dernières années, confirme les
principales conclusions des précédentes études d'efficacité dans la migraine,
c'est-à-dire que le traitement par galcanézumab
conduit à une réduction moyenne du nombre de jours de migraine par mois (4,1
jours par rapport à 1,0 jour dans le groupe placebo, p < 0,0001). La
réduction moyenne du nombre de jours de migraine par mois a également été
observée dans la sous- population atteinte de migraine épisodique (2,9 jours
dans le groupe galcanézumab par rapport à 0,3 jour
dans le groupe placebo ; p < 0,0001) et dans la sous-population atteinte de
migraine chronique (5,9 jours dans le groupe galcanézumab
par rapport à 2,2 jours dans le groupe placebo ; p < 0,0001).
Population pédiatrique
L'Agence européenne des médicaments a différé l'obligation de soumettre les résultats d'études réalisées avec le galcanézumab dans un ou plusieurs sous-groupes de la population pédiatrique dans la prophylaxie de la migraine (voir rubrique Posologie et mode d'administration pour les informations concernant l'usage pédiatrique).
Absorption
D'après une analyse pharmacocinétique (PK) de population, la concentration sérique maximale (Cmax) de galcanézumab après administration d'une dose de charge de 240 mg, est d'environ 30 µg/mL (coefficient de variation (CV) de 27 %) et les concentrations médianes sériques au pic sont atteintes en 5 jours.
La concentration sérique maximale à l'état d'équilibre (Cmax, ss) après des doses mensuelles de 120 mg ou 240 mg est d'environ 28 µg/mL (CV de 35 %) ou 54 µg/mL (CV de 31 %), respectivement. La concentration sérique maximale à l'état d'équilibre du galcanézumab à des doses mensuelles de 120 mg est atteinte après une dose de charge de 240 mg.
L'emplacement du site d'injection (abdomen, cuisse, fesses et bras) n'a pas eu d'effet significatif sur l'absorption du galcanézumab.
Distribution
D'après une analyse pharmacocinétique de la population, le volume de distribution apparent du galcanézumab est de 7,3 L.
Biotransformation
En tant qu'anticorps monoclonal IgG4 humanisé, le galcanézumab serait décomposé en petits peptides et en acides aminés via des voies cataboliques, similaires à celles pour les IgG endogènes.
Élimination
D'après une analyse pharmacocinétique de la population, la clairance apparente du galcanézumab est d'environ 0,008 L/heure et la demi-vie du galcanézumab est de 27 jours.
Linéarité/non-linéarité
L'exposition au galcanézumab augmente proportionnellement à la dose.
D'après une analyse pharmacocinétique de population incluant des doses comprises entre 5 et 300 mg, le taux d'absorption, la clairance apparente et le volume apparent de distribution sont indépendants de la dose.
Âge, sexe, poids, race, origine ethnique
Aucun ajustement posologique n'est nécessaire en fonction de l'âge (18 à 65 ans), du sexe, du poids, de la race ou de l'origine ethnique, car ces facteurs n'ont montré aucun effet cliniquement significatif sur la clairance apparente ou le volume apparent de distribution du galcanézumab.
Insuffisance rénale ou hépatique
Aucune étude de pharmacologie clinique spécifique destinée à évaluer les effets de l'insuffisance rénale et de l'insuffisance hépatique sur les paramètres PK du galcanézumab n'a été menée.
L'élimination rénale d'un anticorps monoclonal IgG est faible. De même, les anticorps monoclonaux IgG sont principalement éliminés par catabolisme intracellulaire et une insuffisance hépatique ne devrait pas influencer la clairance du galcanézumab. D'après une analyse pharmacocinétique de population, la concentration de bilirubine ou la clairance de la créatinine selon Cockcroft-Gault (intervalle : 24 à 308 mL/min) n'a pas montré d'effet significatif sur la clairance apparente du galcanézumab.
Le galcanézumab a une influence mineure sur l'aptitude à conduire des véhicules et à utiliser des machines. Des vertiges peuvent survenir suite à l'administration de galcanézumab (voir rubrique Effets indésirables).
Les données non cliniques issues des études de toxicité en administration répétée menées sur des rats et des singes Cynomolgus ainsi que les évaluations de pharmacologie de la sécurité menées sur des singes Cynomolgus à des expositions 10 à 80 fois supérieures aux expositions cliniques chez les patients traités à une dose de 240 mg n'ont pas révélé de risque particulier pour l'homme.
Aucune étude non clinique n'a été réalisée pour évaluer le potentiel carcinogène ou mutagène du galcanézumab. Il n'existe aucune preuve suggérant qu'un traitement chronique par galcanézumab soit susceptible d'augmenter le risque de carcinogenèse d'après les données des études de pharmacologie et de toxicologie chronique menées avec le galcanézumab, ainsi que d'après une évaluation de la littérature sur le CGRP.
Aucun effet sur les paramètres de fertilité tels que les cycles menstruels, les analyses de sperme ou la reproduction et la performance de reproduction n'a été observé chez les rats auxquels galcanézumab a été administré (exposition environ 4 à 20 fois supérieures à l'exposition thérapeutique chez l'homme à une dose de 240 mg). Dans les études de fertilité pour les mâles, le poids des testicules droits était significativement réduit à des expositions de 4 fois l'exposition humaine à 240 mg.
Au jour 20 de gestation, une augmentation du nombre de fœtus et de portée avec des vertèbres courtes et une diminution du nombre moyen de vertèbres caudales ossifiées sont apparues dans l'étude de toxicité sur le développement embryo-fœtal à une exposition d'environ 20 fois l'exposition humaine à 240 mg. Ces résultats ont été indiqués sans toxicité maternelle et ont été considérés comme liés au galcanézumab mais non défavorables.
Au jour 29 de gestation, dans une étude de toxicité sur le développement embryonnaire et fœtal chez le lapin, une anomalie du crâne a été observée chez un fœtus de sexe masculin dont la mère a été traitée par 240 mg de galcanézumab, soit une exposition environ 33 fois supérieure à l'exposition humaine.
Dans une étude de toxicologie juvénile chez des rats auxquels galcanézumab a été administré deux fois par semaine du 21ème au 90ème jour après la naissance, les effets systémiques étaient de limités à réversibles, minimaux, des diminutions non défavorables du contenu minéral osseux total et de la densité minérale osseuse à des expositions d'environ 50 fois l'exposition humaine à 240 mg.
Manuel d'utilisation
Respecter scrupuleusement le manuel d'utilisation du stylo, inclus avec la notice. Le stylo pré-rempli doit être uniquement utilisé en une seule fois.
Le stylo pré-rempli doit être inspecté visuellement avant toute administration. Emgality ne doit pas être utilisé si la solution est trouble, présente une coloration anormale ou contient des particules, ou si une partie du stylo semble endommagée.
Ne pas secouer.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste
I
Prescription réservée aux spécialistes et services NEUROLOGIE
Remboursement en fonction de l'indication
(JO du 20/01/2021) :
L'indication thérapeutique ouvrant
droit à la prise en charge par l'assurance maladie, concerne uniquement les
patients atteints de migraine sévère avec au moins 8 jours de migraine par
mois, en échec à au moins deux traitements prophylactiques et sans atteinte cardiovasculaire (patients
ayant eu un infarctus du myocarde, angor instable, pontage coronarien, intervention
coronarienne percutanée, accident
vasculaire cérébral, thrombose veineuse profonde ou à autre risque
cardiovasculaire grave).
Solution injectable (injection).
La solution est limpide et incolore à légèrement jaune.
Seringue en verre transparent de type I. La seringue est intégrée dans un stylo jetable à dose unique.
Boîte de 1 stylo pré-rempli.
Boîte de 1 stylo pré-rempli.
Chaque stylo pré-rempli contient 120 mg de galcanézumab dans 1 mL de solution.
Le galcanézumab est un anticorps monoclonal recombinant humanisé produit sur des cellules d'ovaire de hamster chinois.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
L-histidine
Chlorhydrate de L-histidine monohydraté
Polysorbate 80
Chlorure de sodium
Eau pour préparations injectables
Les commandes d’Emgality s’effectuent uniquement
en vente directe Tél : 01 46 24 02 99.