LEUKOTAC 1 mg-mL, solution à diluer pour perfusion, boîte de 5 ampoules de 5 ml
Retiré du marché le : 28/12/2021
Dernière révision : 07/01/2020
Taux de TVA : 0%
Laboratoire exploitant : PHARMA BLUE
Chez l'adulte et chez l'enfant à partir de 28 jours, traitement de la maladie du greffon contre l'hôte aiguë cortico-résistante ou cortico dépendante de grade II à IV après transplantation de cellules souches hématopoïétiques allogéniques
Prescription par un hématologue ou un médecin compétent dans les maladies du sang après validation de l'indication en RCP.
Hypersensibilité à la substance active, ou plus généralement aux protéines de souris ou à l'un des excipients mentionnés à la rubrique Composition.
Réactions à médiation immunologique
Des réactions allergiques peuvent survenir très rarement après administration d'inolimomab. Durant le développement clinique, un patient a présenté une réaction allergique sévère à l'injection d'inolimomab caractérisée par une hypotension, des diarrhées et une hyperthermie.
Inolimomab étant un anticorps d'origine murine, l'apparition d'anticorps humains anti-murins (HAMA) dirigés contre inolimomab a été recherchée chez les patients traités par inolimomab. La présence d'HAMA n'a pas été notée chez les patients présentant une maladie du greffon contre l'hôte aiguë cortico-résistante, probablement liée à l'état sévère d'immunodéficience des patients. Il est à noter que la présence d'HAMA a été rapportée chez moins de 20% des patients dont l'état d'immunodéficience est moindre et traités par inolimomab dans d'autres indications (traitement du rejet après greffe de rein, de foie ou de coeur, traitement de la réaction du greffon contre l'hôte aiguë après transplantation de moelle osseuse mais non résistant aux corticoïdes).
Effets hématologiques
Compte tenu de son mécanisme immunosuppresseur, une surveillance de la numération leucocytaire et plaquettaire doit être mise en place pendant et après le traitement par inolimomab.
Infection
Les patients transplantés recevant de nombreux traitements immunosuppresseurs ont un risque accru de développer des infections opportunistes (comme une infection à cytomégalovirus [CMV]).
L'analyse des données de l'étude clinique de phase 3 dans le traitement de 1ere ligne de la GVH corticorésistante de grade II-IV a montré que le nombre d'infections a été significativement réduit d'au moins de moitié chez les patients traités par inolimomab comparé aux patients traités par sérum antilymphocytaire (voir rubrique Effets indésirables).
Tumeurs malignes
Les patients transplantés recevant de nombreux traitements immunosuppresseurs ont un risque accru de développer des syndromes lymphoprolifératifs post transplantation (comme un lymphome) et d'autres tumeurs malignes.
L'analyse des données de l'étude clinique de phase 3 dans le traitement de 1ere ligne de la GVH corticorésistante de grade II-IV n'a pas montré de différence de fréquence des affections malignes et des syndromes lymphoprolifératifs entre les deux groupes de traitement (inolimomab versus thymoglobuline) (voir rubrique Effets indésirables).
Vaccination
Il n'y a pas de données disponibles sur les effets de la vaccination avec des vaccins vivants ou inactivés, ou sur la transmission d'infections par des vaccins vivants chez les patients recevant inolimomab.
Cependant, l'utilisation de vaccins vivants n'est pas recommandée chez les patients immunodéprimés. L'utilisation de vaccins vivants atténués doit donc être évitée chez les patients traités par inolimomab.
Les vaccins inactivés peuvent être administrés à des patients immunodéprimés ; cependant, la réponse au vaccin peut dépendre du degré d'immunosuppression et de ce fait, la vaccination peut être moins efficace au cours du traitement par inolimomab.
Excipients
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c'est-à-dire qu'il est essentiellement « sans sodium ».
Les effets indésirables graves rapportés chez des patients ayant présenté une GvH après une transplantation de cellules souches hématopoïétiques allogéniques ou une greffe d'organes et exposés à inolimomab lors d'essais cliniques et de programmes compassionnels (n=1414) sont présentés dans le tableau ci-dessous et sont listés par classe de systèmes d'organes et par fréquence, en utilisant la convention suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Sont listés ci-après les évènements indésirables pour lesquels l'investigateur ou le promoteur ont considéré qu'il existait un lien de causalité avec le traitement par inolimomab et les évènements pour lesquels le lien de causalité n'avait pas été rapporté.
| Classes de systèmes-organes | Effets indésirables | |
| Infections et infestations | Fréquent | Infections Sepsis |
| Rare | Choc septique | |
| Tumeurs bénignes, malignes et non précisées (incl kystes et polypes) | Peu fréquent | Tumeur récidivante |
| Rare | Cancer hépatique Lymphome Métastase Tumeur maligne du péritoine | |
| Affections hématologiques et du système lymphatique | Peu fréquent | Anémie Anémie hémolytique microangiopathique Pancytopénie Syndrome hémolytique urémique Thrombocytopénie |
| Affections du système immunitaire | Rare | Hypersensibilité* Maladie du greffon contre l'hôte pulmonaire Réaction anaphylactique* |
| Troubles du métabolisme et de la nutrition | Rare | Obésité |
| Affections psychiatriques | Peu fréquent | Insomnie |
| Rare | Anxiété Humeur dépressive | |
| Affections du système nerveux | Peu fréquent | Convulsion Hémorragie cérébrale |
| Rare | Céphalée Convulsion grand mal Leucoencéphalopathie Syndrome de démyélinisation osmotique | |
| Affections cardiaques | Rare | Extrasystoles ventriculaires Hypertrophie ventriculaire Insuffisance cardiaque Tachycardie |
| Affections vasculaires | Peu fréquent | Collapsus circulatoire Hypertension Maladie veino-occlusive Sténose artérielle |
| Rare | Choc hypovolémique Hypotension | |
| Classes de systèmes-organes | Effets indésirables | |
| Affections respiratoires, thoraciques et médiastinales | Peu fréquent | Pneumopathie interstitielle diffuse |
| Rare | Asthme Hémorragie pulmonaire Œdème pulmonaire Syndrome de détresse respiratoire aiguë | |
| Affections gastro-intestinales | Peu fréquent | Nausée Vomissement |
| Rare | Diarrhée Hémorragie gastro-intestinale | |
| Affections hépatobiliaires | Peu fréquent | Insuffisance hépatique |
| Rare | Cholangite | |
| Affections du rein et des voies urinaires | Peu fréquent | Insuffisance rénale |
| Affections congénitales, familiales et génétiques | Rare | Aplasie |
| Troubles généraux et anomalies au site d'administration | Peu fréquent | Décès Défaillance multiviscérale Fièvre |
| Rare | Détérioration générale de l'état de santé Malaise Progression de la maladie | |
| Investigations | Peu fréquent | Test immunologique |
| Rare | Augmentation des transaminases Pression artérielle diminuée | |
| Lésions, intoxications et complications liées aux procédures | Peu fréquent | Echec de la greffe |
| Rare | Complications après une intervention | |
* Durant le développement clinique (étude INO-0102), un patient a présenté une réaction allergique sévère à l'injection d'inolimomab caractérisée par une hypotension, des diarrhées et une hyperthermie. La présence d'HAMA a été identifiée chez ce patient. Un patient du programme compassionnel a également présenté une réaction anaphylactique caractérisée par une perte de conscience de 30 minutes, une hypotension, une tachycardie et un érythème généralisé lors des deux dernières injections d'inolimomab.
Infections opportunistes :
Tous les patients transplantés présentent un risque accru de développer des infections opportunistes ; ce risque augmente avec la charge totale d'immunosuppression. En effet, avant d'initier inolimomab ces patients sont immunodéprimés ou présentent un risque d'immunodépression à la suite d'un traitement antérieur ou concomitant par corticoïdes, chimiothérapie ou autres médicaments anti-rejet. Chez les patients traités par inolimomab au total 122 infections graves ont été rapportées dont 80 qui ont été considérées comme liées à inolimomab. Les infections les plus fréquemment observées étaient des infections à CMV et herpès, des infections bactériennes (Klebsiella, Legionella, staphylocoque) des infections fongiques (Aspergillus, candida). Le pourcentage de patients présentant une infection ou un sepsis était de 5,7 %.
Tumeurs malignes :
Les patients recevant un traitement immunosuppresseur, comportant plusieurs médicaments en association dont inolimomab, sont exposés à un risque accru de lymphomes et d'autres tumeurs malignes (voir rubrique Mises en garde et précautions d'emploi). Au total, 15 cas ont été signalés depuis le développement d'inolimomab. Parmi eux, 6 tumeurs malignes récurrentes, un cas de leucémie myéloïde aiguë, une tumeur hépatique, un lymphome, des métastases, un mycosis fongoïde, une tumeur maligne du péritoine, une leucémie plasmocytaire et deux cancers épidermoïdes. 8 de ces 15 tumeurs malignes ont été considérées comme étant liée à l'utilisation de l'inolimomab.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté au moyen de la fiche correspondante (voir Annexe B) du protocole d'utilisation thérapeutique d'Inolimomab.
SURVEILLANCE :
- Numération leucocytaire et plaquettaire pendant et après le traitement.
FEMME en AGE de PROCREER : utiliser une méthode de contraception au cours du traitement.
Grossesse
En l'absence de données chez l'animal et de données cliniques, les patients en âge de procréer doivent utiliser une méthode de contraception efficace pendant le traitement par inolimomab.
Allaitement
On ne sait pas si inolimomab passe dans le lait maternel. Il est donc déconseillé d'allaiter pendant un traitement par inolimomab.
Fertilité
Aucune donnée n'est disponible concernant un effet éventuel d'inolimomab sur la fertilité.
Aucune étude d'interaction n'a été réalisée.
Inolimomab étant une immunoglobuline, aucune interaction médicamenteuse métabolique n'est à prévoir.
En plus des corticoïdes, d'autres médicaments administrés habituellement en transplantation ont été utilisés pendant les essais cliniques sans augmentation de la fréquence des effets indésirables. Ces médicaments concomitants comprennent notamment certains immunosuppresseurs, des antiviraux systémiques, des médicaments antibactériens et antifongiques.
L'action d'inolimomab peut être perturbée par des anticorps isotypiques dirigés contre la protéine de souris, ainsi que par l'administration concomitante d'IL-2.
Posologie
Population adulte
Phase d'induction :
LEUKOTAC sera administré à une dose de 0,3 mg/kg/jour pendant 8 jours (jours 1 à 8).
En l'absence de réponse complète (RC) après 8 jours de traitement, une seconde phase d'induction doit être menée pendant 8 jours supplémentaires, à la même posologie que la première induction. L'administration de LEUKOTAC doit être poursuivie jusqu'au jour 16 même si une réponse complète est obtenue avant la fin de la seconde semaine de la phase d'induction.
Phase d'entretien
La phase d'entretien doit être débutée immédiatement après la phase d'induction, au jour 9 ou au jour 17.
LEUKOTAC doit être administré à une dose de 0,4 mg/kg 3 fois par semaine.
En cas de RC le jour 9, la phase d'entretien débute immédiatement après le jour 9 et doit être poursuivie pendant 3 semaines (soit 9 injections).
En l'absence de réponse complète au jour 9 et de poursuite de la phase d'induction jusqu'au jour 16, la phase d'entretien doit être débutée immédiatement après le jour 17 et doit être poursuivie pendant 2semaines (soit 6 injections).
La durée de traitement est d'environ 28 jours. Population pédiatrique (à partir de 28 jours de vie)Phase d'induction :
LEUKOTAC doit être administré à une dose de 0,4 mg/kg/jour pendant 8 jours (jours 1 à 8).
En l'absence de réponse complète (RC) après 8 jours de traitement, une seconde phase d'induction doit être menée pendant 8 jours supplémentaires, à la même posologie. L'administration de LEUKOTAC doit être poursuivie jusqu'au jour 16 même si une réponse complète est obtenue avant la fin de la seconde semaine de la phase d'induction.
Phase d'entretien
La phase d'entretien doit être débutée immédiatement après la phase d'induction.
LEUKOTAC sera administré à une dose de 0,4 mg/kg tous les deux jours (3 fois par semaine).
En cas de RC le jour 9, la phase d'entretien doit être débutée immédiatement après le jour 9 et doit être poursuivie pendant 3 semaines (soit 9 injections).
En l'absence de réponse complète au jour 9 et de poursuite de la phase d'induction jusqu'au jour 16, la phase d'entretien doit être débutée immédiatement après le jour 17 et doit être poursuivie pendant 2 semaines (soit 6 injections).
La durée de traitement est d'environ 28 jours.
Patients âgés (³ 65 ans)
L'expérience acquise avec Inolimomab chez les patients âgés (65 ans et plus) est limitée, aucune donnée ne suggère que les patients âgés nécessitent une posologie différente de celle des patients plus jeunes.
Mode d'administration
La solution diluée de LEUKOTAC doit être administrée en perfusion intraveineuse en 30 minutes. Pour les instructions concernant la dilution du médicament avant administration, voir rubrique Instructions pour l'utilisation, la manipulation et l'élimination.
Durée de conservation :
3 ans.
Après dilution, la solution doit être administrée immédiatement au patient.
Précautions particulières de conservation :A conserver au réfrigérateur (entre 2°C et 8°C)
A conserver dans l'emballage d'origine, à l'abri de la lumière. Ne pas congeler.
Pour les conditions de conservation du médicament après dilution, voir la rubrique Durée de conservation.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
La dose maximale tolérée n'a pas été déterminée chez l'homme et n'a pas pu être atteinte chez les animaux recevant inolimomab.
Classe pharmacothérapeutique : inhibiteur des interleukines, code ATC : L04 AC. Mécanisme d'action
Inolimomab est un anticorps monoclonal murin (IgG1) dirigé contre la chaine alpha du récepteur de l'interleukine-2 (CD25, IL-2R), récepteur exprimé à la surface des lymphocytes T en réponse à une stimulation antigénique. En se liant spécifiquement à l'antigène CD25 (Kd = 10-9M) présent à la surface des lymphocytes T activés exprimant le récepteur de haute affinité pour l'interleukine-2 (IL- 2R), inolimomab empêche la liaison de l'IL-2, signal critique de prolifération des lymphocytes T au cours de la réponse immunitaire impliquée dans la maladie aiguë du greffon contre l'hôte.
Des études in vitro ont montré qu'un blocage de plus de 97% du récepteur à l'IL2 permet d'obtenir une inhibition de la prolifération des lymphocytes T activés entre 80 et 90% et est obtenue pour des concentrations sériques d'inolimomab entre 5 et 10 µg/mL, ces concentrations sériques étant atteintes assez rapidement à partir du deuxième jour d'administration d'inolimomab à la dose de 0,3 mg/kg/j.
Efficacité et sécurité clinique
L'efficacité d'inolimomab pour le traitement de la maladie du greffon contre l'hôte cortico-résistante après transplantation de cellules souches hématopoïétiques allogéniques a été évaluée dans une étude de phase 3 multicentrique (INO-0107) randomisée en double aveugle contrôlée contre Thymoglobuline® (globuline antithymocyte (ATG)) dont l'objectif était de démontrer un taux succès au traitement supérieur chez les patients recevant inolimomab comparé aux patients recevant Thymoglobuline®.
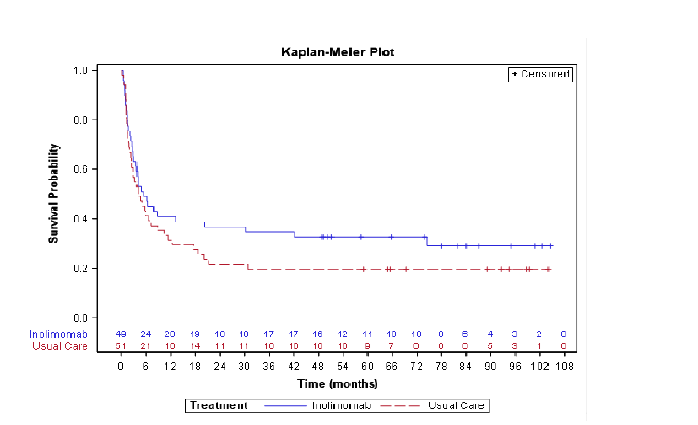
Les résultats cette étude (100 patients ; 49 traités par inolimomab et 51 par ATG) n'ont pas permis d'atteindre le critère primaire de l'étude (critère composite basé sur survie à un an sans changement de traitement). Néanmoins, il est important de rapporter qu'une diminution du risque de décès de 37% en faveur d‘inolimomab a été observée (Hazard Ratio = 0,628, intervalle de confiance [0,389 ; 1,015], p (one sided) = 0,055). Quarante-sept pourcent (47%) des patients (23/49) du groupe inolimomab versus 39% des patients (20/51) du groupe Thymoglobuline® étaient vivants à un an.
Les taux de réponse (réponse complète et partielle) au jour 29 mesurés dans les deux groupes de traitement ne montrent pas de différence significative (42,9% versus 45,1% dans le groupe inolimomab et Thymoglobuline® respectivement). Cependant, la durée de réponse est beaucoup plus longue avec l'inolimomab (durée médiane de réponse de 239 jours dans le groupe inolimomab versus 21 jours dans le groupe Thymoglobuline®).
Des données de survie long terme ont été collectées chez les 43 patients vivants à la fin de l'étude de phase 3 INO-0107 (23 inolimomab ; 20 ATG) et jusqu'à 104 mois après l'arrêt du traitement (médiane de durée de suivi : 58,4 mois). Ces données de suivi long terme ont montré une différence statistiquement significative sur la survie avec une réduction relative du risque de décès de 43% (p=0,030), en faveur d'inolimomab. Ces données confirment les observations à un an de l'étude de phase 3 INO-0107 avec un réel bénéfice clinique sur la survie statistiquement supérieure chez les patients recevant inolimomab. A noter, qu'aucune différence n'a été observée entre les deux groupes concernant la survenue d'une maladie du greffon contre l'hôte chronique, que ce soit après 1 an de suivi ou lors de l'analyse du suivi à long terme.
Figure 1 : Courbe de survie long terme des patients de l'étude de phase 3 INO-0107 (médiane de suivi : 58,4 mois)
Au cours de l'essai clinique, le nombre d'effets indésirables observés dans le groupe contrôle Thymoglobuline® était 20 à 30% supérieur à celui observé dans le groupe traité par inolimomab, cette différence étant statistiquement significative (p<0,001). De plus une réduction statistiquement significative (p=0,004) d'un facteur 3 concernant le nombre de patients ayant expérimenté un effet indésirable relié au traitement a été observée en faveur d'inolimomab.
La survenue des infections est réduite significativement (p<0,001) chez les patients traités par inolimomab comparé aux patients recevant Thymoglobuline® avec particulièrement une réduction des évènements infectieux mettant en jeu le pronostic vital tels que les sepsis (14% inolimomab versus 24% Thymoglobuline®) ou les chocs septiques (4% sous inolimomab versus 16% sous Thymoglobuline®).
Population pédiatrique
A ce jour, aucune étude clinique prospective n'a été conduite dans la population pédiatrique. Toutefois inolimomab a été administré chez 147 enfants présentant une maladie du greffon contre l'hôte aiguë cortico-résistante ou cortico dépendante dans le cadre d'autorisations temporaires d'utilisation nominatives. Une analyse rétrospective conduite sur les données collectées dans le cadre de cette utilisation a montré un taux de réponse globale (réponse complète et réponse partielle) de 68% au jour 20 après administration d'inolimomab et un taux de survie à un an de 60%.
La pharmacocinétique d'inolimomab a été évaluée chez 21 patients traités 8 jours aux doses de 0,10 ; 0,20 ; 0,30 ; 0,40 mg/kg/jour (étude INO-0102) ainsi que chez 49 patients traités avec 0,3 mg/kg/jour suivis de 0,4 mg/kg/jour trois fois par semaine (étude INO-0107).
Une analyse de pharmacocinétique de population conduite sur la base d'un modèle bi-compartimental avec une élimination linéaire a permis d'estimer une demi-vie de 44,5h, une clairance à 0,076 L/h et un volume de distribution de la phase terminale à 4,84 L dans le cadre de l'étude INO-0102, des valeurs similaires ayant été observées lors de la conduite de l'étude INO-0107.
Les effets de LEUKOTAC sur l'aptitude à conduire des véhicules et à utiliser des machines n'ont pas été étudiés.
Inolimomab a été bien toléré après administration unique (14,3 mg/kg, équivalent à 36 fois la dose recommandée chez l'homme) et répétée (jusqu'à 7,5 mg/kg/jour pendant 18 jours) chez le rat ainsi que chez le singe (jusqu'à 7,5 mg/kg/jour pendant 14 jours). Chez le singe, dans le groupe ayant reçu la plus forte dose d'inolimomab (7,5 mg/kg/jour), une femelle a été sacrifiée du fait de son état général. Toutefois cela n'a pas été attribué à un effet lié à l'administration d'inolimomab. Chez les singes traités à haute dose une déplétion lymphoïde réversible après arrêt du traitement a été observée.
Inolimomab n'a pas montré de génotoxicité au cours des tests standards.
Les effets d'inolimomab sur la reproduction, la fertilité, la tératogénicité n'ont pas été étudiés.
LEUKOTAC NE DOIT PAS être injecté directement. Le produit doit être dilué conformément aux bonnes pratiques, en particulier en matière de respect de l'asepsie, dans 50 à 100 mL de sérum physiologique (NaCl 0,9%) avant d'être administré par voie intraveineuse aux patients. Après ouverture, les ampoules doivent être utilisées immédiatement.
Pour la dilution utiliser un filtre 0,22 µm stérile, apyrogène, à faible liaison aux protéines :
1. Collecter le contenu de 1 à 10 ampoules de LEUKOTAC, selon la posologie prescrite, dans une seringue,
2. Fixer le filtre sur la seringue de prélèvement,
3. Injecter le contenu de la seringue à travers le filtre dans la poche de dilution (50 à 100 mL de NaCl 0,9%)
Pour effectuer le mélange, ne pas agiter la solution, mais retourner doucement la poche afin d'empêcher la formation de mousse.
Un examen visuel de la poche doit être effectué avant administration afin de déceler la présence éventuelle de particules. Ne pas utiliser en cas de présence de particules.
Aucun autre médicament ou produit ne doit être ajouté ou injecté simultanément dans la même tubulure.
Une fois la perfusion préparée, elle doit être administrée immédiatement par voie intraveineuse.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Médicament réservé à l'usage hospitalier.
Médicament à prescription réservée aux spécialistes en hématologie ou
aux médecins compétents en maladies du sang après validation de
l'indication en RCP.
Solution à diluer pour perfusion
Solution incolore
Ampoule en verre incolore de type I de 5 mL contenant 5 mg d'inolimomab. Chaque boîte contient 5 ampoules.