IXIARO, suspension injectable. Vaccin de l'encéphalite japonaise (inactivé, adsorbé), boîte de 1 seringue préremplie de ½ mL
Dernière révision : 19/03/2021
Taux de TVA : 2.1%
Laboratoire exploitant : VALNEVA FRANCE
IXIARO est indiqué pour l'immunisation active contre l'encéphalite japonaise chez l'adulte, l'adolescent, l'enfant et le nourrisson de plus de 2 mois.
L'administration d'IXIARO doit être envisagée chez les sujets exposés à un risque d'infection par le virus lors d'un voyage ou dans le cadre de leur activité professionnelle.
Hypersensibilité à la substance active, à l'un des excipients mentionnés à la rubrique Liste des excipients ou aux résidus (sulfate de protamine, formaldéhyde, albumine sérique bovine, ADN de la cellule hôte, métabisulfite de sodium [voir la rubrique 2.], protéine de la cellule hôte).
La
seconde dose du vaccin ne doit pas être administrée aux sujets ayant
présenté des réactions d'hypersensibilité après l'administration de la
première dose.
L'administration du vaccin doit être différée chez les patients présentant une affection fébrile aiguë sévère.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Comme
avec tous les vaccins injectables, il est recommandé de toujours
disposer d'un traitement médical approprié et d'assurer une
surveillance afin de traiter les rares cas de réaction anaphylactique
survenant après l'administration du vaccin.
IXIARO ne doit en aucun cas être administré par voie intravasculaire.
Comme
tous les vaccins, IXIARO peut ne pas protéger tous les sujets vaccinés.
IXIARO ne protège pas de l'encéphalite causée par d'autres
micro-organismes.
Comme pour toute injection intramusculaire, ce vaccin ne doit pas être
administré par voie intramusculaire chez les sujets présentant une
thrombocytopénie, une hémophilie ou un risque d'hémorragies (voir
rubrique Posologie et mode d'administration).
Chez l'adulte, des taux de séroconversion de 29,4 % et 97,3 % ont été
respectivement observés 10 jours après la première dose par voie i.m.
et une semaine après la seconde dose par voie i.m selon le schéma
conventionnel. Après une immunisation selon le schéma rapide, un taux
de séroconversion de 99 % a été observé 7 jours après la seconde dose
par voie i.m. Par conséquent, la primo-vaccination doit être achevée au
minimum une semaine avant l'exposition potentielle au virus de
l'encéphalite japonaise (VEJ).
La protection contre l'encéphalite japonaise n'est pas assurée tant que la seconde dose n'a pas été administrée.
Résumé du profil de sécurité
La sécurité
d'IXIARO a été évaluée dans des études cliniques contrôlées et non contrôlées
menées sur 5 021 adultes sains (de pays non endémiques) et sur 1 559 enfants et
adolescents (principalement issus de pays endémiques).
Des effets indésirables systémiques ont été rapportés chez environ 40 % des
sujets vaccinés et des réactions au site d'injection ont été rapportées chez
environ 54 % des sujets vaccinés. Ils surviennent habituellement dans les trois
premiers jours suivant la vaccination, sont généralement légers et
disparaissent au bout de quelques jours. Aucune augmentation du nombre d'effets
indésirables n'a été constatée entre l'administration de la première dose et
l'administration de la seconde ou à la suite de la dose de rappel chez les
adultes.
Les effets indésirables les plus fréquemment rapportés chez les adultes sont :
céphalées (20 %), myalgies (13 %) douleur au site d'injection (33 %),
sensibilité au site d'injection (33 %) et fatigue (12,9 %).
Les effets indésirables les plus fréquemment rapportés chez les enfants et les adolescents sont : fièvre, diarrhée, syndrome pseudo-grippal, irritabilité, douleur au site d'injection, sensibilité au site d'injection et rougeur au site d'injection (voir tableau 1).
Les effets
indésirables sont énumérés selon les fréquences suivantes :
Très fréquents : ≥ 1/10
Fréquents : ≥ 1/100, < 1/10
Peu fréquent s: ≥ 1/1 000, < 1/100
Rares : ≥ 1/10 000, < 1/1 000
adultes et personnes âgées (> 65 ans)
Affections
hématologiques et du système lymphatique
Peu fréquent : lymphadénopathie
Rare : thrombocytopénie
Affections
du système nerveux
Très fréquent : céphalées
Peu fréquents : migraine, sensation vertigineuse
Rares : paresthésie, névrite, dysgueusie, syncope*
Affections
oculaires
Rare : œdème de la paupière
Affections
de l'oreille et du labyrinthe
Peu fréquent : vertiges
Affections
cardiaques
Rares : palpitations, tachycardie
Affections
respiratoires, thoraciques et médiastinales
Rare : dyspnée
Affections
gastro-intestinales
Fréquent : nausées
Peu fréquents : vomissements, diarrhée, douleurs abdominales
Affections
de la peau et du tissu sous-cutané
Peu fréquents : rash, prurit, hyperhidrose
Rares : urticaire, érythème
Affections
musculo-squelettiques et systémiques
Très fréquent : myalgies
Peu fréquent : raideur musculo-squelettique, arthralgies
Rares : douleurs aux extrémités
Troubles
généraux et anomalies au site d'administration
Très fréquents : douleur au site d'injection, sensibilité au site d'injection,
fatigue
Fréquents : syndrome pseudo-grippal, pyrexie, autres réactions au site
d'injection (par ex., rougeur, induration, tuméfaction, prurit)
Peu fréquents : frissons, malaise, asthénie Rare : œdème périphérique
· Signalée
également par l'expérience post-commercialisation.
Tests Biologiques
Peu fréquent :
élévation des enzymes hépatiques
Population pédiatrique (2 mois - moins de 18 ans)
Tableau 1 : Fréquence des effets indésirables observés chez les enfants (2 mois à < 3 ans) ayant reçu la dose de 0,25 ml et chez les enfants et adolescents (3 ans à < 18 ans) ayant reçu la dose de 0,5 ml.
|
Fréquence des effets indésirables (%) en fonction de la dose et de l'âge |
||
|
Classe de systèmes d'organes Terme privilégié |
0,25 ml N = 783 2 mois à < 3 ans |
0,5 ml N = 628 3 ans à < 18 ans |
|
Affections hématologiques et du système lymphatique |
||
|
Lymphadénopathie |
0,1 |
0,0 |
|
Troubles du métabolisme et de la nutrition |
||
|
Appétit diminué |
8,2 |
1,9 |
|
Affections du système nerveux |
||
|
Céphalées |
2,9 |
6,1 |
|
Affections respiratoires, thoraciques et médiastinales |
||
|
Toux |
0,5 |
0,3 |
|
Affections gastro-intestinales |
||
|
Diarrhée |
11,9 |
1,4 |
|
Vomissements |
7,3 |
1,9 |
|
Nausées |
3,9 |
1,9 |
|
Douleur abdominale |
0,1 |
0,0 |
|
Affections de la peau et du tissu sous-cutané |
||
|
Rash |
6,3 |
1,4 |
|
Affections musculo-squelettiques et systémiques |
||
|
Myalgies |
3,0 |
7,1 |
|
Troubles généraux et anomalies au site d'administration |
||
|
Pyrexie |
28,5 |
10,4 |
|
Syndrome pseudo-grippal |
10,9 |
2,9 |
|
Irritabilité |
10,9 |
1,9 |
|
Fatigue |
3,5 |
3,5 |
|
Rougeur au site d'injection |
10,0 |
4,1 |
|
Douleur au site d'injection |
6,1 |
14,1 |
|
Sensibilité au site d'injection |
4,2 |
14,7 |
|
Gonflement au site d'injection |
3,6 |
2,2 |
|
Induration au site d'injection |
1,2 |
1,9 |
|
Démangeaisons au site d'injection |
0,6 |
1,6 |
|
Investigations |
||
|
Élévation des enzymes hépatiques |
0,5 |
0,2 |
Déclaration des effets indésirables suspectés
La
déclaration des effets indésirables suspectés après autorisation du médicament
est importante. Elle permet une surveillance continue du rapport
bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet
indésirable suspecté via le système national
de déclaration - voir Annexe V.
En zone endémique : malgré la vaccination, prendre des précautions adéquates pour limiter les piqûres de moustiques (vêtements appropriés, utilisation de répulsifs, moustiquaires).
Grossesse
Il existe peu de données sur l'utilisation d'IXIARO pendant la grossesse. Des données de pertinence clinique incertaine ont été obtenues dans des études menées chez l'animal (voir rubrique Données de sécurité préclinique). Par mesure de précaution, l'utilisation d'IXIARO doit être évitée pendant la grossesse.
Allaitement
On ne sait pas si IXIARO est excrété dans le lait humain.
Aucun effet sur le nouveau-né/le nourrisson allaité n'est anticipé,
étant donné que l'exposition systémique de la femme allaitante à IXIARO
est négligeable. Cependant, en l'absence de données et par mesure de
précaution, l'utilisation d'IXIARO doit être évitée pendant
l'allaitement.
Fertilité
Une étude menée chez le rat n'a pas mis en évidence d'effets du vaccin
sur la reproduction féminine, le poids fœtal, la survie et le
développement de la descendance.
Administration concomitante d'IXIARO avec d'autres vaccins :
L'administration concomitante d'IXIARO, du vaccin inactivé contre
l'hépatite A et du vaccin inactivé rabique selon deux schémas
différents a été évaluée dans des études cliniques. Aucun impact sur la
réponse immunitaire aux vaccins contre le VEJ, l'hépatite A ou le virus
de la rage n'a été observé (voir rubrique Propriétés pharmacodynamiques).
L'administration concomitante d'IXIARO avec d'autres vaccins étudiés
n'a pas entraîné de modification de leur profil de sécurité.
Une réponse immunitaire satisfaisante peut ne pas être obtenue chez les
patients sous traitement immunosuppresseur ou présentant un déficit
immunitaire.
Population pédiatrique
Aucune étude d'interaction n'a été réalisée chez l'enfant et l'adolescent.
Posologie
Adultes (18 à ≤ 65 ans)
La primo-vaccination consiste en deux injections séparées de 0,5 ml
chacune, administrées selon le schéma conventionnel suivant :
Première dose : jour 0.
Seconde dose : 28 jours après la première dose.
Schéma de vaccination rapide
Les adultes âgés de 18 à ≤ 65 ans peuvent être vaccinés suivant un schéma de vaccination rapide comme suit :
Première dose : jour 0.
Seconde dose : 7 jours après la première dose.
Quel que soit le schéma, la primo-vaccination doit être achevée au minimum une semaine avant l'exposition potentielle au virus de l'encéphalite japonaise (VEJ) (voir rubrique Mises en garde spéciales et précautions d'emploi).
Il est recommandé aux personnes ayant reçu la première dose d'IXIARO de terminer le schéma de primo- vaccination en 2 doses avec IXIARO.
Chez les sujets n'ayant reçu qu'une seule dose en primo-vaccination, une protection totale contre la maladie pourrait ne pas être obtenue. Certaines données montrent, après une seconde injection administrée jusqu'à 11 mois après la première, des taux élevés de séroconversion (voir section 5.1).
Dose de rappel
Une dose de rappel (troisième dose) doit être administrée au cours de
la seconde année (c.-à-d. 12-24 mois) après la primo-vaccination, avant
une exposition potentielle au virus de l'encéphalite japonaise (VEJ).
Les personnes à risque continu d'infection par le virus de
l'encéphalite japonaise (personnel de laboratoire ou personnes résidant
dans une zone endémique) doivent recevoir une dose de rappel 12 mois
après la primo- vaccination (voir rubrique Propriétés pharmacodynamiques).
Les données de séroprotection à long terme après une première dose de
rappel administrée entre 12 et 24 mois après la primo-vaccination
suggèrent qu'une seconde dose de rappel devrait être administrée 10 ans
après la première dose de rappel, avant une exposition potentielle au
VEJ.
Personnes âgées (> 65 ans)
La primo-vaccination consiste en deux injections séparées de 0,5 ml
chacune, administrées selon le schéma conventionnel suivant :
Première dose le jour 0.
Seconde dose : 28 jours après la première dose.
La primo-vaccination doit être achevée au minimum une semaine avant l'exposition potentielle au virus de l'encéphalite japonaise (VEJ) (voir rubrique Mises en garde spéciales et précautions d'emploi).
Il est recommandé aux personnes ayant reçu la première dose d'IXIARO de terminer le schéma de primo- vaccination en 2 doses avec IXIARO.
Chez les sujets n'ayant reçu qu'une seule dose en primo-vaccination, une protection totale contre la maladie pourrait ne pas être obtenue. Certaines données montrent, après une seconde injection administrée jusqu'à 11 mois après la première, des taux élevés de séroconversion (voir rubrique Propriétés pharmacodynamiques).
Dose de rappel
Comme avec de nombreux vaccins, la réponse immunitaire induite par
IXIARO est plus faible chez les personnes âgées que chez les adultes
plus jeunes. La durée de la protection étant incertaine chez les
personnes âgées, une dose de rappel (troisième dose) doit être
envisagée avant toute exposition au virus de l'EJ. La séroprotection à
long terme après une dose de rappel n'est pas connue.
Population pédiatrique
Enfants et adolescents âgés de 3 ans à moins de 18 ans
La primo-vaccination consiste en deux injections séparées de 0,5 ml chacune, administrées selon le schéma suivant :
Première dose : jour 0.
Seconde dose : 28 jours après la première dose.
Enfants âgés de 2 mois à moins de 3 ans
La primo-vaccination consiste en deux injections séparées de 0,25 ml chacune, administrées selon le schéma suivant :
Première dose : jour 0.
Seconde dose : 28 jours après la première dose.
Voir la rubrique Précautions particulières d'élimination et de manipulation pour les consignes de préparation de la dose de 0,25 ml pour les enfants âgés de 2 mois à moins de 3 ans.
Il est recommandé aux personnes ayant reçu la première dose d'IXIARO de terminer le schéma de primo- vaccination en 2 doses avec IXIARO.
Dose de rappel (enfants et adolescents)
Une
dose de rappel (troisième dose) doit être administrée au cours de la
seconde année (c'est-à-dire 12 - 24 mois) après la primo-vaccination,
avant une exposition potentielle au VEJ.
Les enfants et les adolescents présentant un risque continu d'infection
par le virus de l'encéphalite japonaise (car ils résident dans une zone
endémique) doivent recevoir une dose de rappel 12 mois après la primo-
vaccination (voir rubrique Propriétés pharmacodynamiques).
Les enfants et les adolescents entre 3 ans et moins de 18 ans doivent recevoir une seule dose de rappel de 0,5 ml.
Les enfants entre 14 mois et moins de 3 ans doivent recevoir une seule dose de rappel de 0,25 ml. Voir la rubrique Précautions particulières d'élimination et de manipulation pour en savoir plus sur la préparation d'une dose de 0,25 ml pour les enfants entre 2 mois et moins de 3 ans.
Aucune donnée de séroprotection à long terme au-delà de deux ans après
l'administration du premier rappel 1 an après la primo-vaccination n'a
été générée chez les enfants.
Enfants âgés de moins de 2 mois
La sécurité et l'efficacité d'IXIARO chez les enfants âgés de moins de
2 mois n'ont pas été établies. Aucune donnée n'est disponible.
Mode d'administration
Le
vaccin doit être administré par injection intramusculaire dans le
muscle deltoïde. Chez les nourrissons, la région antérolatérale de la
cuisse peut être utilisée comme site d'injection. IXIARO ne doit jamais
être injecté par voie intravasculaire.
L'administration concomitante d'IXIARO avec d'autres vaccins
injectables nécessite d'utiliser des seringues distinctes, ainsi que
des sites d'injection différents.
Exceptionnellement, IXIARO peut également être administré par voie sous-cutanée chez les sujets présentant une thrombocytopénie ou un risque d'hémorragies en raison de l'apparition possible d'un saignement lors de l'administration par voie intramusculaire. L'administration sous-cutanée peut entraîner une réponse insuffisante au vaccin (voir rubrique Mises en garde spéciales et précautions d'emploi). Il convient toutefois de noter que l'on ne dispose pas de données d'efficacité clinique appuyant l'administration par voie sous-cutanée.
Durée de conservation :
3 ans
Précautions particulières de conservation :
À conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler. À conserver dans l'emballage d'origine à l'abri de la lumière.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
Aucun symptôme inhérent au surdosage n'a été rapporté.
Population pédiatrique :
Aucun cas de surdosage n'a été rapporté dans la population pédiatrique.
L'administration, par inadvertance, d'une dose de 0,5 ml d'IXIARO chez
des enfants âgés de 1 à 3 ans ne pose pas de problème de sécurité (voir
rubrique Propriétés pharmacodynamiques).
Classe pharmacothérapeutique : vaccins, vaccins viraux, vaccins contre l'encéphalite, code ATC : J07BA02
Mécanisme d'action
Le mécanisme d'action des vaccins contre l'encéphalite japonaise (EJ) est mal connu. Des études menées chez l'animal ont montré que le vaccin stimule le système immunitaire et induit la production d'anticorps dirigés contre le VEJ, le plus souvent protecteurs. Des épreuves de provocation ont été réalisées chez des souris traitées avec des sérums humains anti-IXIARO. Ces études ont révélé que la quasi-totalité des souris chez qui le titre mesuré au test de neutralisation par réduction des plages (PRNT) était supérieur ou égal à 1:10 étaient protégées lors d'une infection d'épreuve létale par le virus de l'encéphalite japonaise.
Efficacité et sécurité cliniques
L'efficacité d'IXIARO n'a fait l'objet d'aucune étude prospective. L'immunogénicité d'IXIARO a été étudiée chez environ 3 119 adultes sains inclus dans sept essais de phase III randomisés et contrôlés et cinq essais de phase III non contrôlés, et chez environ 550 enfants en bonne santé inclus dans deux essais de phase III randomisés et contrôlés et deux essais de phase III non contrôlés.
Essai pivot d'immunogénicité (chez l'adulte)
L'immunogénicité
du vaccin a été évaluée dans un essai clinique de phase III
multicentrique, randomisé et avec traitement de référence mené à l'insu
de l'investigateur auprès de 867 sujets sains de sexe masculin et
féminin recevant IXIARO ou le vaccin contre le VEJ homologué aux
États-Unis, JE-VAX (administré les jours 0, 7 et 28 par injection
sous-cutanée). Les co-critères d'évaluation primaires étaient le taux
de séroconversion (titre des anticorps anti-VEJ ≥ 1:10) et la moyenne
géométrique des titres (MGT) au jour 56, déterminée à l'aide d'un test
de neutralisation par réduction des plages (PRNT) pour l'ensemble de la
population de l'étude.
Au jour 56, la proportion de sujets ayant présenté une séroconversion
était similaire dans les deux bras de traitement (96,4 % contre 93,8 %
sous IXIARO et JE-VAX, respectivement). Au jour 56, la MGT avait
augmenté pour atteindre 243,6 sous IXIARO et 102,0 pour JE-VAX,
respectivement. Les réponses immunitaires induites par IXIARO n'étaient
pas substantiellement inférieures à celles induites par JE-VAX (tableau
2).
Tableau 2 : Taux de séroconversion et moyenne géométrique des titres associés à IXIARO et JE-VAX dans la population per protocole. Les titres d'anticorps neutralisants dirigés contre le VEJ ont été déterminés en utilisant la souche SA14-14-2 du VEJ.
| Taux de séroconversion | ||
| Date | IXIARO N=365 % (n) | JE-VAX N=370 % (n) |
| Visite 0 (sélection) | 0 | 0 |
| Visite 3 (jour 28) | 54 (197) | 86,8 (321) |
| Visite 4 (jour 56) | 96,4 (352) | 93,8 (347) |
| Moyenne géométrique des titres (par PRNT) | ||
| Date | IXIARO N=365 MGT (n) | JE-VAX N=370 MGT (n) |
| Visite 0 (sélection) | 5,0 (365) | 5,0 (370) |
| Visite 3 (jour 28) | 17,4 (363) | 76,9 (367) |
| Visite 4 (jour 56) | 243,6 (361) | 102,0 (364) |
Dans
cette étude comparative avec traitement de référence, l'impact de l'âge
sur la réponse immunitaire à IXIARO et JE-VAX a été évalué en tant que
critère d'évaluation secondaire. Les sujets âgés de 50 ans et plus
(N=262, âge moyen : 59,8) ont été comparés à ceux âgés de moins de 50
ans (N=605, âge moyen : 33,9).
Aucune différence significative n'a été observée entre le taux de
séroconversion induit par IXIARO et celui induit par JE-VAX chez les
sujets de moins de 50 ans par rapport à ceux âgés de 50 ans et plus au
jour 28 ou 56 après la vaccination. Au jour 28, la moyenne géométrique
des titres était significativement plus élevée chez les sujets âgés de
moins de 50 ans que chez ceux âgés de 50 ans et plus dans le bras
JE-VAX (80,9 contre 45,9, p=0,0236). Toutefois, aucune différence
significative n'a été observée au jour 56 dans ce groupe de traitement.
Aucun effet significatif de l'âge sur la moyenne géométrique des titres
n'a été observé dans le bras recevant IXIARO. En ce qui concerne les
taux de séroconversion, aucune différence significative n'a été
observée entre le groupe de sujets de moins de 50 ans et le groupe de
sujets âgés de 50 ans et plus au jour 28 ou au jour 56 dans l'un ou
l'autre des bras de traitement.
Persistance des anticorps (chez l'adulte)
La persistance des anticorps a été évaluée dans une étude de suivi de
phase III non contrôlée menée chez des sujets ayant achevé deux études
pivots et reçu au moins une dose d'IXIARO. L'immunogénicité à long
terme d'IXIARO a été évaluée jusqu'au mois 24 suivant la
primo-vaccination dans un sous-groupe de 181 sujets (population en
intention de traiter [ITT]) et jusqu'au mois 36 chez 152 sujets.
Le pourcentage de sujets avec un titre en anticorps neutralisants ≥1:10 (PRNT50)
et la moyenne géométrique des titres aux mois 2, 6, 12, 24 et 36 sont
présentés dans le tableau 3 pour la population en intention de traiter.
Tableau 3 : Pourcentage de sujets avec titre en anticorps neutralisants ≥1:10 (PRNT50) et moyenne géométrique des titres (MGT) aux mois 2, 6, 12, 24 et 36 après la vaccination par IXIARO (population ITT)
| | Pourcentage de sujets avec titre ≥1:10 | MGT | ||
| Date | % (n/N) | Intervalle de confiance à 95 % | MGT (N) | Intervalle de confiance à 95 % |
| Mois 2 | 98,9 (179/181) | [96,1 ; 99,7] | 310,8 (181) | [268,8 ; 359,4] |
| Mois 6 | 95,0 (172/181) | [90,8 ; 97,4] | 83,5 (181) | [70,9 ; 98,4] |
| Mois 12 | 83,4 (151/181) | [77,3 ; 88,1] | 41,2 (181) | [34,4 ; 49,3] |
| Mois 24 | 81,8 (148/181) | [75,5 ; 86,7] | 44,3 (181) | [36,7 ; 53,4] |
| Mois 36 | 84,9 (129/152) | [78,32 ; 89,70] | 43,8 (152) | [36,5 ; 52,6] |
La baisse de la MGT observée était telle qu'attendue et comparable à celle rapportée avec d'autres vaccins inactivés contre l'EJ.
Une
autre étude de suivi ouverte de phase III a évalué la persistance des
anticorps jusqu'à 24 mois après la primo-vaccination. Un total de 116
sujets ayant reçu le schéma recommandé de primo-vaccination par IXIARO
ont été inclus. Le pourcentage de sujets avec un titre en anticorps
neutralisants ≥1:10 était de82,8 % (IC à 95 % : 74,9 ; 88,6, N=116) au mois 6 et de 58,3 % au mois 12 (IC à 95 % : 49,1 ; 66,9, N=115).\
Au mois 24, 48,3% (IC à 95 % : 39,4 ; 57,3, N=116) des sujets ayant
terminé la primo-immunisation recommandée présentaient toujours des
titres PRNT50 ≥1:10. La MGT de ces sujets s'élevait à 16,2 (IC à 95 % : 13,8 ; 19,0) au mois 24.
Immunisation de rappel (chez l'adulte)
Dans une étude ouverte non contrôlée de phase III, une dose unique de
rappel de 6 µg d'IXIARO (0,5 ml) a été administrée au mois 15 après la
primo-immunisation. Tous les 198 sujets traités ont été inclus dans les
populations ITT et de sécurité.
Le pourcentage de sujets avec un titre en anticorps neutralisants ≥1:10 (PRNT50) et la MGT en fonction du temps figurent au tableau 4 :
Tableau 4 : Pourcentage de sujets avec un titre en anticorps neutralisants ≥1:10 (PRNT50) et MGT avant et aux mois 1, 6 et 12 après une dose unique de rappel de 6 µg (0,5 ml) administrée aux sujets 15 mois après la primo-immunisation par IXIARO recommandée (population ITT)
| | Pourcentage de sujets avec un titre PRNT50 ≥1:10 | MGT | ||
| | | IC à 95 % | | IC à 95 % |
| Avant rappel, jour 0 (n=198) | 69,2 % | [62,4 % ; 75,2 %] | 22,5 | [19,0 ; 26,7] |
| Jour 28 (n=198) | 100,0 % | [98,1 % ; 100,0 %] | 900,1 | [742,4 ; 1 091,3] |
| Mois 6 (n=197) | 98,5 % | [95,6 % ; 99,5 %] | 487,4 | [390,7 ; 608,1] |
| Mois 12 (n=194) | 98,5 % | [95,6 % ; 99,5 %] | 361,4 | [294,5 ; 443,5] |
Persistance des anticorps après la vaccination de rappel (adultes)
Dans une prolongation ouverte non contrôlée de l'étude sur les rappels
décrite ci-dessus, 67 sujets ont fait l'objet d'un suivi pour
déterminer les titres d'anticorps de neutralisation du VEJ environ 6
ans après l'injection d'une dose de rappel. 96 % des sujets (64/67)
possédaient encore des niveaux protecteurs d'anticorps (PRNT50≥1:10),
avec une MGT de 148 (IC à 95 % : 107 ; 207). La modélisation
mathématique a été appliquée pour déterminer la durée moyenne de
protection. Ce modèle permet d'estimer que la durée moyenne de
protection sera de 14 ans et que 75 % des personnes vaccinées
conserveront un taux protecteur d'anticorps (PRNT50≥1:10)
pendant 10 ans. Un second rappel doit donc être administrée 10 ans
après la première dose de rappel, administrée 1 an après la
primo-vaccination, avant toute exposition potentielle au VEJ.
Schéma d'immunisation rapide (adultes)
L'immunogénicité d'IXIARO administré selon un schéma de vaccination
rapide a été évaluée lors d'une étude de phase III randomisée, menée à
l'insu de l'investigateur. Un total de 217 sujets âgés de 18 à ≤ 65 ans
ont reçu une dose d'IXIARO avec un vaccin rabique inactivé (Rabipur) le
jour 0 et le jour 7 selon un schéma de vaccination rapide et 56 sujets
ont reçu une dose d'IXIARO seule le jour 0 et le jour 28 selon le
schéma d'immunisation conventionnel. La proportion de sujets ayant
présenté une séroconversion à 7 et 28 jours après la dernière
immunisation était similaire dans les deux schémas. Les taux de
séroconversion et les titres d'anticorps sont également restés élevés
de manière comparable jusqu'à 12 mois après la première immunisation
dans ces deux schémas (tableau 5).
Le schéma rapide a été testé pour l'administration concomitante
d'IXIARO et de Rabipur, mais il peut également servir pour administrer
uniquement l'IXIARO, car aucune interférence dans la réponse
immunitaire des deux vaccins n'a été observée (voir la section 4.5).
Tableau 5 : Taux de séroconversion et MGT des anticorps neutralisants anti-VEJ les jours 0, 14, 21, 35, 56 et 365 après l'immunisation avec IXIARO et un vaccin rabique inactivé selon un schéma rapide et avec IXIARO seul selon un schéma conventionnel (population per protocole)
| | Taux de séroconversion (pourcentage de sujets avec un titre PRNT50≥1:10) | MGT (test de neutralisation par réduction des plages) | ||
| | Schéma rapide % (n/N) | Schéma conventionnel % (n/N) | Schéma rapide (N) | Schéma conventionnel (N) |
| Schéma de vaccination | IXIARO - Jour 0, 7 Rabipur - Jour 0, 3, 7 | IXIARO - Jour 0, 28 - | IXIARO - Jour 0, 7 Rabipur - Jour 0, 3, 7 | IXIARO - Jour 0, 28 - |
| Jour 0 | 6 (13/215) | 9 (5/55) | 5,63 (215) | 5,73 (55) |
| Jour 14 | 99 (206/209) | NA | 715 (209) | NA |
| Jour 21 | 100 (207/208) | NA | 1 255 (208) | NA |
| Jour 35 | 99 (203/206) | 100 (47/47) | 690 (206) | 376 (47) |
| Jour 56 | 98 (200/204) | 100 (49/49) | 372 (204) | 337 (49) |
| Jour 365 | 94 (188/199) | 88 (42/48) | 117 (199) | 39 (48) |
NA = non applicable
Primo-immunisation incomplète (chez l'adulte)
L'immunogénicité de doses de rappel a également été évaluée par une
étude examinant la persistance de l'immunité à la suite de différents
schémas de primo-immunisation (2x6 µg : N=116, 1x12 µg : N=116 ou 1x6
µg : N=117). Une dose unique de rappel de 6 µg (0,5 ml) était
administrée 11 ou 23 mois après la première dose aux sujets avérés
séronégatifs (titres PRNT50
< 1:10) aux mois 6 et/ou 12 après la primo- immunisation. Les
résultats indiquent que la deuxième injection de primo-immunisation
peut s'administrer jusqu'à 11 mois après la première. Les réponses
immunitaires à d'autres doses à des moments différents après la
primo-immunisation complète ou incomplète figurent au tableau 6.
Tableau 6 : Taux de séroconversion (TSC) et MGT quatre semaines après une dose unique de rappel de 6 µg administrée à des sujets avec titre PRNT50 <1:10 (PRNT50<1:10 signifie que le sujet n'est plus séroprotégé) au mois 11 ou 23 après la primo-immunisation par IXIARO recommandée (2x6 µg) ou incomplète (1x6 µg) (population ITT)
| | (n / N) | TSC | MGT | [IC à 95 %] |
| Rappel après la primo-immunisation recommandée (2x6 µg) | | | | |
| Rappel au mois 11 | (17/17) | 100 % | 673,6 | [378,7 ; 1 198,2] |
| Rappel au mois 23 | (27/27) | 100 % | 2536,7 | [1 467,7 ; 4 384,4] |
| Deuxième dose après primo- immunisation incomplète (1x6 µg) | | | | |
| Deuxième dose au mois 11 | (99/100) | 99 % | 504,3 | [367,3 ; 692,3] |
| Deuxième dose au mois 23 | (5/5) | 100 % | 571,4 | [88,2 ; 3 702,9] |
Administration concomitante (chez l'adulte)
Administration concomitante d'IXIARO et du vaccin inactivé contre l'hépatite A (VHA) (HAVRIX 1440) L'administration
concomitante d'IXIARO et du vaccin inactivé contre l'hépatite A (VHA)
(HAVRIX 1440) a été étudiée dans un essai clinique. Aucun impact sur la
réponse immunitaire au virus de l'EJ et au VHA, respectivement, n'a été
observé. L'étude a montré que l'administration concomitante d'IXIARO et
du vaccin inactivé contre l'hépatite A par rapport aux vaccins
administrés seuls ne diminuait substantiellement ni la MGT d'anticorps
neutralisants anti-VEJ et d'anticorps anti-VHA, ni le taux de
séroconversion (TSC) pour ces deux types d'anticorps (tableau 7).
Tableau 7 : Taux de séroconversion et moyenne géométrique des titres d'anticorps neutralisants anti-VEJ au jour 56 et taux de séroconversion et moyenne géométrique des titres d'anticorps anti-VHA au jour 28 dans la population per protocole
| Taux de séroconversion et moyenne géométrique des titres d'anticorps neutralisants anti-VEJ à J56 | |||
| | TSC (%) | MGT | IC à 95 % |
| Groupe C: IXIARO + HAVRIX1440 | 100,0 | 202,7 | [153,7 ; 261,2] |
| Groupe A: IXIARO + Placebo | 98,2 | 192,2 | [147,9 ; 249,8] |
| Taux de séroconversion et titre moyen géométrique d'anticorps anti-VHA au jour 28 | |||
| | TSC (%) | MGT | IC à 95 % |
| Groupe C: IXIARO + HAVRIX 1440 | 100,0 | 150,0 | [111,7 ; 202,3] |
| Groupe B: HAVRIX + Placebo | 96,2 | 124,0 | [91,4 ; 168,2] |
Administration concomitante d'IXIARO et du vaccin inactivé contre la rage (Rabipur) :
Dans une étude de phase III menée à l'insu de l'investigateur,
l'administration concomitante d'IXIARO et de Rabipur a été étudiée chez
des adultes âgés de 18 à ≤ 65 ans et comparée à des vaccinations
uniques respectives réalisées selon un schéma conventionnel. Aucune
interférence n'a été observée concernant la moyenne géométrique des
titres (MGT) et les taux de séroconversion des anticorps neutralisants
anti-VEJ (tableau 8). L'absence d'interférence a également été
constatée avec la réponse immunitaire à Rabipur.
Tableau 8 : Taux de séroconversion (pourcentage de sujets avec un titre PRNT50≥1:10) et MGT (test de neutralisation par réduction des plages) des anticorps neutralisants anti-VEJ après l'administration d'IXIARO et de Rabipur selon un schéma conventionnel, population per protocole
| Taux de séroconversion et moyenne géométrique des titres d'anticorps neutralisants anti-VEJ à J56 | ||
| | TSC [%] (n/N) | MGT [IC à 95 %] (N) |
| IXIARO + Rabipur | 100 (157/157) | 299 [254 ; 352] (157) |
| IXIARO | 100 (49/49) | 337 [252 ; 451] (49) |
Schémas de vaccination : IXIARO : jours 0/28, Rabipur : jours 0/7/28.
Immunogénicité chez les personnes âgées (> 65 ans)
L'immunogénicité d'IXIARO a été évaluée lors d'un essai en ouvert non
contrôlé chez 200 personnes en bonne santé âgées de > 65 à 83 ans,
incluant des sujets présentant des affections sous-jacentes stables
comme l'hypercholestérolémie, l'hypertension, une maladie
cardiovasculaire ou un diabète non insulino-dépendant. Les taux
d'anticorps neutralisants VEJ ont été déterminés 42 jours après
l'injection de la seconde dose de primovaccination (jour 70). Les
personnes âgées présentent une réponse immunitaire plus faible à la
vaccination que les adultes plus jeunes ou les enfants en termes de
taux de séroconversion (pourcentage de sujets avec un titre PRNT50 ≥1:10) et de moyenne géométrique des titres (tableau 9).
Tableau 9 : Taux de séroconversion et moyenne géométrique des titres des anticorps neutralisants VEJ au jour 70 chez une population en intention de traiter, population entière de l'étude en fonction de l'âge
| Taux de séroconversion et moyenne géométrique des titres d'anticorps neutralisants anti-VEJ à J70 | ||||
| | n / N | TSC | MGT | IC à 95 % |
| Population totale de l'étude | 128/197 | 65 % | 37 | 29,2 ;47,8 |
| Groupe > 65 - < 75 ans | 113/173 | 65,3 % | 37,2 | 28,6 ; 48,3 |
| Groupe ≥ 75 ans | 15/23 | 65,2 % | 42,2 | 19,2 ; 92,7 |
Population pédiatrique
Dans une étude de phase II menée chez des enfants indiens sains âgés d'au moins 1 et de moins de 3 ans, 24 enfants ont reçu une dose de 0,25 ml d'IXIARO (la dose homologuée dans cette tranche d'âge) et 24 enfants ont reçu la dose de 0,5 ml prévue pour les adultes. Bien que limitées, les données obtenues n'ont montré aucune différence entre la dose de 0,25 ml et la dose de 0,5 ml en termes de profil de sécurité dans cette tranche d'âge.
Immunogénicité et sécurité d'IXIARO chez l'enfant et l'adolescent dans des pays où l'EJ est endémique
La sécurité et l'immunogénicité d'IXIARO ont été évaluées au cours d'un
essai clinique randomisé, contrôlé, en ouvert, mené aux Philippines où
le VEJ est endémique. Le profil de sécurité d'IXIARO a été comparé aux
vaccins de contrôle Havrix (vaccin de l'hépatite A, formulation
pédiatrique 720 U / 0,5 ml) et Prevenar (vaccin pneumococcique conjugué
7-valent [protéine CRM197 de la diphtérie]).
L'évaluation de l'immunogénicité qui a été effectuée dans un sous-groupe de la population de l'étude comprenait la détermination du taux de séroconversion (TSC), défini comme un titre d'anticorps neutralisants anti-VEJ ≥ 1:10, la proportion de sujets présentant une multiplication par au moins quatre des titres d'anticorps et la moyenne géométrique des titres (MGT) au jour 56 et au mois 7, par dose et par groupe d'âge. Les réponses immunitaires induites par IXIARO sont présentées dans le tableau 10.
Tableau 10 : Taux de séroconversion, proportion de sujets présentant une multiplication par au moins 4 des titres d'anticorps neutralisants anti-VEJ et moyenne géométrique des titres, à l'inclusion dans l'étude, au jour 56 et au mois 7, stratifiés par groupe d'âge, dans la population en intention de traiter
| Dose de vaccin | 0,25 ml | 0,5 ml | |||
| Groupe d'âge | 2 mois - < 6 mois | 6 mois - < 12 mois | 1 an - < 3 ans | 3 ans - < 12 ans | 12 ans - < 18 ans |
| Taux de séroconversion en % (n/N) | |||||
| Avant vaccination | 30 % (3/10) | 0 % (0/20) | 3,2 % (4/125) | 16,8 % (17/101) | 45,7 % (64/140) |
| Jour 56 | 100 % (9/9) | 100 % (19/19) | 99,2 % (119/120) | 100,0 % (100/100) | 100 % (137/137) |
| Mois 7 | 100 % (10/10) | 100 % (18/18) | 85,5 % (106/124) | 91,0 % (91/100) | 97,1 % (133/137) |
| Proportion de sujets présentant une multiplication ≥ 4 des titres d'anticorps anti-VEJ en % (n/N) | |||||
| Jour 56 | 100 (9/9) | 94,7 (18/19) | 96,7 (116/120) | 94,0 (94/100) | 77,4 (106/137) |
| Mois 7 | 90,0 (9/10) | 83,3 (15/18) | 75,8 (94/124) | 71,0 (71/100) | 65,0 (89/137) |
| Moyenne géométrique des titres (N) | |||||
| Avant vaccination | 8,42 (10) | 5* (20) | 5,52 (124) | 6,54 (101) | 13,08 (140) |
| Jour 56 | 687,35 (9) | 377,79 (19) | 258,90 (121) | 213,67 (100) | 175,63 (137) |
| Mois 7 | 159,27 (10) | 64,00 (18) | 38,91 (125) | 43,60 (100) | 86,61 (137) |
*Une valeur de 5 a été imputée aux titres négatifs avant vaccination.
La sécurité et la tolérance ont été évaluées dans l'ensemble de la population de l'étude. Les parents ou les patients ont noté les événements indésirables dans un journal pendant les 7 jours suivant chaque administration du vaccin. Il a été demandé aux parents ou aux patients de noter les EI spontanés le jour de la deuxième administration du vaccin et au moment des visites des patients programmées 28 jours (jour 56) et 6 mois (mois 7) après la deuxième administration et qui incluaient un examen médical. Le profil de sécurité d'IXIARO était comparable aux profils de sécurité d'Havrix et de Prevenar.
Persistance des anticorps et dose de rappel chez les enfants et les adolescents dans les pays où le VEJ est endémique
La persistance des anticorps neutralisant du VEJ après la
primo-vaccination ainsi que la sécurité et l'immunogénicité d'une dose
de rappel IXIARO 12 mois après la primo-vaccination ont été évaluées
dans un essai clinique randomisé, contrôlé, en ouvert, mené aux
Philippines où le VEJ est endémique (300 enfants entre 1,2 et 17,3 ans,
âge moyen de 5,3 ans). 150 enfants ont fait l'objet d'un suivi pendant
une durée maximale de 3 ans sans rappel, un autre groupe de 150 enfants
a reçu une dose de rappel 1 an après la primo- vaccination (0,25 ml si
moins de 3 ans à la date du rappel et 0,5 ml si 3 ans et plus) et a
fait l'objet d'un suivi pendant deux années supplémentaires. Le taux de
séroprotection (TSP) défini en tant que titre en anticorps
neutralisants ≥1:10 et la moyenne géométrique des titres (MGT) sont
indiqués dans le tableau 11. La dose de rappel a induit une hausse
prononcée de la MGT et le maintien du taux de séroprotection à 100 %
deux ans après le rappel.
Tableau 11 : Taux de séroprotection et moyenne géométrique des titres avec et sans rappel d'IXIARO à 12, 13, 24 et 36 mois, dans la population en intention de traiter
| | Sans rappel N = 150 | Dose de rappel 12 mois après la primo-vaccination N = 149 | |
| Date après primo- vaccination | | Dose de rappel de 0,25 ml N=81 | Dose de rappel de 0,5 ml N=67 |
| Taux de séroprotection % (n/N) | |||
| Mois 12 | 89,9 (134/149) | 97,5 (79/81) | 89,6 (60/67) |
| Mois 13 | nd | 100 (81/81) | 100,0 (67/67) |
| Mois 24 | 89,0 (130/146) | 100 (80/80) | 100,0 (67/67) |
| Mois 36 | 90,1 (128/142) | 100,0 (76/76) | 100,0 (67/67) |
| Moyenne géométrique des titres | |||
| Mois 12 | 46 | 67 | 40 |
| Mois 13 | nd | 2 911 | 1 366 |
| Mois 24 | 50 | 572 | 302 |
| Mois 36 | 59 | 427 | 280 |
nd = non disponible
Immunogénicité et sécurité chez l'enfant et l'adolescent dans les pays non endémiques
La sécurité et l'immunogénicité d'IXIARO ont été évaluées lors d'un
essai clinique non contrôlé, en ouvert, en cours de réalisation aux
États-Unis, en Europe et en Australie chez des volontaires sains hommes
et femmes ayant prévu de voyager dans des zones où le VEJ est
endémique. Les enfants et les adolescents âgés de plus de 3 ans et de
moins de 18 ans ont reçu deux doses de 0,5 ml de vaccin et les enfants
âgés de plus de 2 mois et de moins de 3 ans ont reçu deux doses de 0,25
ml de vaccin au jour 0 et au jour 28 en injection intramusculaire. Les
données d'immunogénicité ont été évaluées chez 64 sujets. Les TSC et
les MGT sont présentés dans le tableau 12.
Tableau 12 : Taux de séroconversion et moyennes géométriques des titres d'anticorps neutralisants anti- VEJ par dose de vaccin et par groupe d'âge. Population en intention de traiter.
| | Dose d'IXIARO | Moment | TSC n / N | MGT | IC à 95 % |
| Groupe d'âge ≥ 2 mois à < 3 ans | 0,25 ml | Jour 56 | 100 % 5/5 | 216,2 | 106,0 ; 441,0 |
| | | Mois 7 | 100 % 2/2 | 48,0 | 0,0 ; 3214485,7 |
| Groupe d'âge ≥ 3 ans à < 18 ans | 0,5 ml | Jour 56 | 100 % 57/57 | 340,7 | 269,8 ; 430,3 |
| | | Mois 7 | 90,6 % 29/32 | 57,1 | 38,4 ; 84,9 |
Persistance des anticorps et dose de rappel chez les enfants et les adolescents dans des pays non endémiques
La persistance des anticorps a été évaluée pendant trois ans après la
primo-vaccination avec IXIARO lors d'un essai clinique non contrôlé de
suivi en ouvert, réalisé aux États-Unis, en Europe et en Australie. Les
données d'immunogénicité à long terme ont été évaluées chez 23
enfants entre 3 et 18 ans (âge moyen de 14,3 ans). Les TSP et les MGT
sont présentés dans le tableau 13.
Tableau 13 : Taux de séroprotection et moyennes géométriques des titres d'anticorps neutralisants anti-VEJ par dose de vaccin et par groupe d'âge. Population en intention de traiter
| | Taux de séroprotection (% de sujets avec PRNT50≥1:10) % (n/N) | Moyenne géométrique des titres (test de neutralisation par réduction des plages) MGT [IC de 95 %] | ||
| | Après dose de primo- vaccination de 0,25 ml | Après dose de primo-vaccination de 0,5 ml | Après dose de primo-vaccination de 0,25 ml | Après dose de primo-vaccination de 0,5 ml |
| Mois 12 | 0 % (0/0) | 89,5 % (17/19) | - | 48 [28 ; 80] |
| Mois 24 | 100 % (1/1) | 90,9 % (20/22) | 193 [nd] | 75 [46 ; 124] |
| Mois 36 | 100 % (1/1) | 88,9 % (16/18) | 136 [nd] | 61 [35 ; 106] |
nd L'intervalle de confiance à 95% n'a pas pu être déterminé (données basées sur un seul sujet)
Non applicable.
IXIARO n'a aucun effet ou qu'un effet négligeable sur l'aptitude à conduire des véhicules ou à utiliser des machines.
Les données relatives à la toxicité préclinique sont limitées.
Dans une étude de toxicité sur la reproduction et le développement pré-/post-natal, aucun effet délétère associé au vaccin sur la reproduction, le poids fœtal, la survie et le développement de l'enfant n'a été détecté. Une ossification incomplète de plusieurs parties du squelette a toutefois été observée dans le groupe recevant 2 doses, mais pas dans le groupe recevant 3 doses. Il est pour l'instant difficile de déterminer si ce phénomène est ou non lié au traitement.
La seringue préremplie est à usage unique ; elle ne doit pas être utilisée pour plus d'une personne. La seringue préremplie est prête à l'emploi. Si l'aiguille n'est pas fournie, utiliser une aiguille stérile.
Ne pas utiliser le vaccin si l'emballage en aluminium n'est pas intact ou si le conditionnement est endommagé.
Lors de la conservation du vaccin, un fin dépôt de couleur blanche et un surnageant incolore transparent peuvent être observés.
Avant l'administration, bien agiter la seringue pour obtenir une suspension blanche, opaque et homogène. Ne pas administrer si le produit comporte des particules après avoir été agité, si une décoloration est observée ou si la seringue paraît endommagée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation locale en vigueur.
Informations sur l'administration d'une dose de 0,5 ml d'IXIARO chez les personnes âgées de 3 ans et plus
Pour l'administration de la totalité de la dose de 0,5 ml, suivre les étapes suivantes :
1. Agiter la seringue pour obtenir une suspension homogène.2. Enlever le protège embout de la seringue en le dévissant doucement. Ne pas tenter de briser ou d'arracher le protège embout ; cela pourrait abîmer la seringue.
3. Fixer une aiguille sur la seringue préremplie.
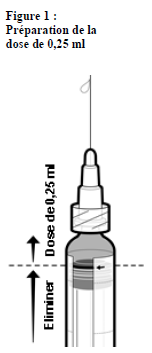
Informations sur la préparation d'une dose de 0,25 ml d'IXIARO pour les enfants âgés de moins de 3 ans
Pour l'administration d'une dose de 0,25 ml chez des enfants âgés de 2 mois à moins de 3 ans, suivre les étapes suivantes :1. Agiter la seringue pour obtenir une suspension homogène.
2. Enlever le protège embout de la seringue en le dévissant doucement. Ne pas tenter de briser ou d'arracher le protège embout ; cela pourrait abîmer la seringue.
3. Fixer une aiguille sur la seringue préremplie.
4. Tenir la seringue en position verticale.
5. Appuyer sur le bouchon-piston jusqu'à la ligne rouge sur le cylindre de la seringue, indiquée par une flèche rouge (voir Figure 1)*, pour éliminer la quantité en excès
6. Fixer une nouvelle aiguille stérile avant d'injecter la quantité restante.
* Si vous dépassez la ligne rouge lorsque vous appuyez sur le bouton-piston, la dose de 0,25 ml n'est plus garantie. Une nouvelle seringue doit donc être utilisée.
liste I
Suspension injectable.
Liquide transparent avec un précipité blanc.
0,5 ml de suspension en seringue préremplie (verre de type I) avec bouchon-piston (élastomère chlorobutyl). Boîte de 1 seringue sans aiguille séparée.
1 dose (0,5
ml) d'IXIARO contient:
Virus de l'encéphalite japonaise, souche SA14-14-2 (inactivé)1,2
6 AU3
Activité correspondante
≤ 460 ng DE50
1 Produite sur cellules Vero
2 Adsorbée sur hydroxyde
d'aluminium hydraté (environ 0,25 milligramme d'Al3+)
3 Unités antigène
Excipients à
effet notoire :
Ce médicament contient moins de 1 mmol (39 mg) de potassium par dose unique de
0,5 ml et moins de 1 mmol (23 mg) de sodium par dose unique de 0,5 ml c.-à-d.
qu'il est essentiellement « sans potassium » et « sans sodium ». Ce produit
peut contenir des traces résiduelles de métabisulfite de sodium, inférieures au
seuil de détection
La composition en sels de la solution saline tamponnée phosphate 0,0067 M (en
PO4) est comme suit :
NaCl - 9 mg/ml
KH2PO4 - 0,144 mg/ml
Na2HPO4 - 0,795 mg/ml
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Solution saline tamponnée phosphate composée de :
Chlorure de sodium
Phosphate monopotassique
Phosphate disodique
Eau pour préparations injectables
Pour l'adjuvant, voir rubrique 2.