ENANTONE LP 11,25 mg, microsphères et solution pour usage parentéral (S.C. ou I.M.) à libération prolongée, boîte de 1 flacon de poudre dispositif ampoule de solvant de 2 ml
Retiré du marché le : 31/07/2018
Dernière révision : 23/12/2016
Taux de TVA : 2.1%
Prix de vente : 231,11 €
Taux remboursement SS : 65%
Base remboursement SS : 231,11 €
Laboratoire exploitant : TAKEDA FRANCE
o Traitement du cancer de la prostate localement avancé ou métastatique.
o Traitement concomitant et adjuvant à la radiothérapie externe dans le cancer de la prostate localement avancé (stade T3-T4 de la classification TNM ou stade C de la classification AUA)
· Traitement de l'endométriose à localisation génitale et extragénitale (du stade I au stade IV).
L'expérience clinique relative au traitement de l'endométriose est limitée aux femmes âgées de 18 ans et plus.
Durée du traitement : voir rubrique Posologie et mode d'administration.
· Traitement de la puberté précoce centrale (avant 9 ans chez la fille, avant 10 ans chez le garçon).
Ce médicament ne doit pas être prescrit en cas:
· Hypersensibilité à la substance active, à la GnRH, aux analogues de la GnRH ou à l'un des excipients mentionnés à la rubrique Composition,
· Grossesse et allaitement
· Chez les filles avec puberté précoce centrale : hémorragie génitale de cause non déterminée.
· Dans le cas d'un traitement de l'endométriose associant ENANTONE et une hormonothérapie de substitution, les contre-indications d'utilisation d'estroprogestatifs doivent être respectées.
Il existe un risque accru de survenue de dépression incidente (qui peut être sévère) chez les patients traités par agonistes de la GnRH, tels que la leuproréline. Les patients doivent être informés en conséquence et traités de façon appropriée si des symptômes apparaissent.
Une apoplexie hypophysaire peut survenir de façon très rare lors de la première administration chez des patients présentant un adénome hypophysaire, en particulier gonadotrope. Les symptômes qui peuvent évoquer cette pathologie sont des céphalées et des troubles visuels.
Les traitements par privation androgénique peuvent allonger l'intervalle QT.
Chez les patients ayant un antécédent ou des facteurs de risque d'allongement de l'intervalle QT et chez les patients recevant un traitement concomitant qui risque d'allonger l'intervalle QT (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions), le rapport bénéfice risque incluant le risque potentiel de torsade de pointe devra être évalué avant l'instauration du traitement par ENANTONE.
Des cas de convulsions ont été rapportés chez les patients traités par la leuproréline après sa mise sur le marché. Ces convulsions ont été observées aussi bien chez les adultes que chez les enfants, avec ou sans antécédents, troubles, ou facteurs de risque liés aux convulsions.
Cancer de la prostate:
Des cas isolés d'aggravation des symptômes (en particulier de douleurs osseuses), souvent transitoire, ont été observés lors de l'instauration d'un traitement par les analogues de la GnRH.
Une surveillance attentive sera effectuée lors de l'instauration du traitement et pendant les premières semaines suivant celle-ci:
· chez les patients porteurs d'une obstruction des voies excrétrices,
· chez les malades présentant des métastases vertébrales (voir rubrique Effets indésirables),
· chez les sujets présentant des signes annonçant une compression médullaire.
En début de traitement, une augmentation transitoire des phosphatases acides peut être observée.
Une privation androgénique à long terme, consécutive à une orchidectomie bilatérale ou à l'administration d'analogues de la GnRH, est associée à une augmentation du risque de perte osseuse qui, chez les patients présentant des facteurs de risques supplémentaires, peut conduire à l'ostéoporose et à une augmentation du risque de fracture osseuse (voir rubrique Effets indésirables).
Des données épidémiologiques ont montré que des modifications métaboliques (par exemple réduction de la tolérance au glucose ou aggravation d'un diabète préexistant) ainsi qu'une augmentation du risque de maladie cardiovasculaire peuvent survenir pendant un traitement par privation androgénique. Toutefois, les données prospectives n'ont pas confirmé le lien entre le traitement par analogues de la GnRH et une augmentation de la mortalité cardiovasculaire. Les patients à haut risque de maladies cardiovasculaires ou métaboliques doivent être surveillés de façon appropriée.
Endométriose:
L'absence de grossesse sera vérifiée avant toute prescription de ce médicament.
En cas d'association d'une hormonothérapie de substitution au traitement de l'endométriose par ENANTONE, les mises en garde et les précautions d'emploi des estroprogestatifs doivent être respectées.
Précautions d'emploi
Cancer de la prostate:
La testostéronémie doit être vérifiée périodiquement en cours de traitement sa valeur ne devant pas être supérieure à 1 ng/ml.
Une appréciation de la réponse au traitement sera effectuée périodiquement par un examen clinique et prostatique (toucher rectal), des dosages sanguins (dosage de l'antigène prostatique spécifique ou PSA), voire une scintigraphie osseuse.
Endométriose:
L'administration d'une injection d'ENANTONE L.P.11,25 mg entraîne dans tous les cas une aménorrhée hypogonadotrophique.
En dehors du premier mois de traitement, la survenue de métrorragies au cours du traitement est anormale et doit conduire à la réalisation de dosages du taux d'estradiol plasmatique. Si celui-ci est inférieur à 50 pg/ml, une recherche d'éventuelles lésions organiques associées doit être effectuée.
Dans le cas d'un traitement de l'endométriose associant ENANTONE et une hormonothérapie de substitution (« add-back therapy »), des métrorragies peuvent se produire, en relation avec le traitement hormonal de substitution.
En cas d'association de l'hormonothérapie de substitution au traitement de l'endométriose par ENANTONE, des précautions particulières sont nécessaires afin d'écarter des patientes présentant une thrombophilie.
En cas d'administration prolongée, il est recommandé de surveiller la masse osseuse afin de mieux prendre en compte le risque d'ostéoporose (voir rubrique Effets indésirables).
Puberté précoce centrale :
Avant de commencer le traitement, un diagnostic précis de puberté précoce centrale idiopathique et/ou neurogénique doit être posé.
Le traitement est un traitement au long cours, adapté de manière individuelle.
ENANTONE LP 11,25 mg doit être administré dans la mesure du possible de manière régulière tous les 3 mois. Un retard exceptionnel de quelques jours dans la date de l'injection (90 ± 2 jours) n'influence pas les résultats du traitement.
Dans le cas d'un abcès stérile au site d'injection (principalement rapporté en cas d'administration IM de doses supérieures aux doses recommandées), l'absorption de leuproréline peut être diminuée. Dans ce cas les paramètres hormonaux (testostérone, estradiol) doivent être surveillés à intervalle de 2 semaines (voir rubrique Posologie et mode d'administration).
Le traitement des enfants avec une tumeur cérébrale évolutive doit faire l'objet d'une évaluation individuelle attentive du rapport bénéfices risques.
Après la première injection chez les filles, des saignements vaginaux, des spotting et des sécrétions peuvent apparaître en signe de privation hormonale. L'apparition de saignements vaginaux au-delà des deux premiers mois de traitement doit être explorée.
Le traitement par les agonistes de la GnRH peut entraîner une diminution de la densité minérale osseuse (DMO). Toutefois, après l'arrêt du traitement, le bilan ultérieur de la masse osseuse est préservé et le pic de croissance de la masse osseuse à la fin de la puberté ne semble pas être affecté par le traitement.
Une épiphysiolyse fémorale peut se produire après l'arrêt du traitement. Il se pourrait que ce soit consécutif à l'affaiblissement du cartilage de conjugaison en raison des faibles concentrations en oestrogène pendant le traitement par les agonistes de la GnRH et à l'augmentation de la vitesse de croissance qui se produit après l'arrêt du traitement et qui faciliterait le déplacement des épiphyses.
Dans tous les cas :
Altération d'humeur, dépression ont été fréquemment observées lors des traitements à long terme et peu fréquemment lors des traitements à court terme.
Une intolérance locale à type de réaction inflammatoire ou de nodule sous-cutané au point d'injection a été rapportée, en particulier chez l'enfant. Si celle-ci persiste, le traitement devra être interrompu.
Comme avec d'autres agonistes de la GnRH, de très rares cas d'apoplexie hypophysaire ont été rapportés au cours de la première administration chez des patients porteurs d'un adénome hypophysaire.
De très rares cas de développement d'adénomes hypophysaires ont été décrits lors des traitements par agonistes de la LH-RH.
De très rares cas de réactions anaphylactiques ont été rapportées (urticaire, angioedème et exceptionnellement choc anaphylactique) aussi bien chez les adultes que chez les enfants traités par la leuproréline.
Cancer de la prostate :
Les effets indésirables rapportés avec une fréquence supérieure ou égale à 0,5% chez des patients recevant de la leuproréline sont listés ci-dessous selon la classification MedDRA (par classe organe et de fréquence absolue). Les fréquences sont définies comme suit : très fréquent (> 1/10), fréquent (> 1/100, < 1/10), peu fréquent (> 1/1 000, < 1/100), rare (> 1/10 000, < 1/1 000), très rare (< 1/10 000), cas isolés, non connus (ne pouvant être estimés à partir des données disponibles).
Investigations :
Très fréquent : prise de poids.
Fréquent : augmentation de l'alanine aminotransférase, augmentation de la gamma glutamyl transférase, augmentation de la lactico déshydrogénase.
Peu fréquent : augmentation de la phosphatase alcaline.
Affections hématologiques et du système lymphatique :
Fréquent : anémie.
Affections du système nerveux :
Fréquent : céphalées.
Peu fréquent : étourdissement, paresthésie.
Fréquence inconnue : convulsions.
Affections respiratoires, thoraciques et médiastinales :
Fréquent : dyspnée.
Affections gastro-intestinales :
Fréquent : nausées, constipation.
Peu fréquent : vomissement, diarrhées.
Affections du rein et des voies urinaires :
Très fréquent : nycturie, dysurie.
Fréquent : pollakiurie, hématurie.
Affections de la peau et du tissu sous-cutané :
Très fréquent : sudation.
Fréquent : prurit.
Peu fréquent : éruption.
Affections musculo-squelettiques et systémiques :
Très fréquent : douleur osseuse, faiblesse musculaire.
Fréquent : douleur dorsale, arthralgie.
Peu fréquent : myalgie, douleur des extrémités.
Troubles du métabolisme et de la nutrition :
Fréquent : anorexie, diminution de l'appétit
Infections et infestations :
Fréquent : infection des voies urinaires.
Affections cardiaques :
Fréquence inconnue : allongement de l'intervalle QT (voir rubriques Mises en garde et précautions d'emploi et Interactions avec d'autres médicaments et autres formes d'interactions).
Affections vasculaires :
Très fréquent : bouffées de chaleur.
Fréquent : lymphoedème.
Troubles généraux et anomalies au site d'administration :
Très fréquent : fatigue.
Fréquent : réaction au point d'injection, douleur, oedème périphérique, douleur au point d'injection.
Peu fréquent : douleur thoracique, asthénie, oedème au point d'injection.
Affections hépatobiliaires :
Fréquent: fonction hépatique anormale.
Affections des organes de la reproduction et du sein:
Très fréquent : impuissance, atrophie testiculaire, trouble testiculaire.
Fréquent : gynécomastie.
Affections psychiatriques :
Très fréquent : diminution de la libido.
Fréquent : altération d'humeur, dépression lors des traitements à long terme, trouble du sommeil.
Mise en route du traitement (voir rubrique Mises en garde et précautions d'emploi) : elle est parfois accompagnée d'une accentuation des signes cliniques et des symptômes (en particulier des douleurs osseuses).
Quelques cas d'aggravation d'une hématurie préexistante ou d'une obstruction urinaire, de sensations de faiblesse ou de paresthésies des membres inférieurs ont été signalés avec les analogues de la GnRH.
Ces manifestations sont habituellement transitoires, disparaissant en 1 à 2 semaines lors de la poursuite du traitement. Néanmoins, la possibilité d'une exacerbation temporaire des symptômes durant les premières semaines de traitement doit être prise en compte chez des malades menacés par la survenue de désordres neurologiques ou chez ceux présentant une obstruction urinaire.
En cours de traitement : Les effets indésirables les plus fréquents liés à l'activité pharmacologique du produit sont: bouffées de chaleur, sueurs, impuissance, diminution de la libido et diminution de la taille des testicules.
Avec d'autres agonistes de la GnRH, d'autres effets indésirables ont été observés : fièvre (de l'ordre de 3 à 4 %), palpitations, troubles de la vue, chute des cheveux, modification de la tolérance au glucose, leucopénie et thrombopénie (moins de 1%).
Variations de la densité osseuse :
Une diminution de la densité osseuse a été rapportée dans la littérature médicale chez les hommes ayant bénéficié d'une orchidectomie ou ceux traités par un agoniste de la GnRH. Il est probable qu'un traitement à long terme par la leuproréline révèle des signes d'aggravation d'ostéoporose, en ce qui concerne l'augmentation du risque de fracture d'origine ostéoporotique.
Endométriose :
Les effets indésirables rapportés avec une fréquence supérieure ou égale à 0,5% chez des patientes recevant de la leuproréline sont listés ci-dessous selon la classification MedDRA (par classe organe et de fréquence absolue). Les fréquences sont définies comme suit: très fréquent (> 1/10), fréquent (> 1/100, < 1/10), peu fréquent (> 1/1 000, < 1/100), rare (> 1/10 000, < 1/1 000), très rare (< 1/10 000), cas isolés, non connus (ne pouvant être estimés à partir des données disponibles).
Investigations :
Fréquent : prise de poids, perte de poids.
Peu fréquent : augmentation de l'alanine aminotransférase, augmentation de la lactico deshydrogénase, augmentation du phosphore sanguin, augmentation des triglycérides.
Affections cardiaques :
Peu fréquent : palpitation.
Affections du système nerveux :
Très fréquent : céphalées.
Fréquent : étourdissements, paresthésies, hypertonie.
Peu fréquent : hypoesthésie.
Fréquence inconnue : convulsions.
Affections oculaires :
Peu fréquent : trouble visuel, amblyopie.
Affections gastro-intestinales :
Fréquent : nausées, douleur abdominale, constipation.
Peu fréquent : flatulence, bouche sèche, vomissement, diarrhées.
Affections du rein et des voies urinaires :
Peu fréquent : dysurie.
Affections de la peau et du tissu sous-cutané :
Fréquent : sueurs, acné, éruption, sécheresse cutanée.
Peu fréquent : séborrhée, alopécie, trouble du cheveu, ecchymose.
Affections musculo-squelettiques et systémiques :
Fréquent : arthralgie, raideur des épaules, douleur dorsale.
Peu fréquent : douleur de la nuque, myalgies, raideur de la nuque, arthropathie.
Troubles du métabolisme et de la nutrition :
Peu fréquent : hypercholestérolémie, anorexie.
Affections vasculaires :
Très fréquent : bouffées de chaleur.
Troubles généraux et anomalies au site d'administration :
Fréquent : asthénie, douleur, oedème périphérique, douleur au point d'injection, induration au point d'injection, douleur thoracique.
Peu fréquent : frissons, fatigue, rougeur au point d'injection.
Affections des organes de la reproduction et du sein:
Très fréquent : vaginite.
Fréquent : sécheresse vaginale, douleur mammaire.
Peu fréquent : douleur pelvienne, atrophie mammaire, leucorrhée.
Affections psychiatriques :
Très fréquent : trouble du sommeil.
Fréquent : altération d'humeur, dépression lors des traitements à long terme, instabilité émotionnelle, diminution de la libido, nervosité.
Peu fréquent : anxiété, confusion.
Instauration du traitement :
L'instauration du traitement peut s'accompagner d'une exacerbation des symptômes de l'endométriose (douleurs pelviennes, dysménorrhée) qui peut être observée lors de l'augmentation initiale et transitoire du taux plasmatique d'estradiol ; ces signes disparaissent en une à deux semaines.
La survenue de métrorragies peut être observée dans le mois suivant la première injection.
En cours de traitement :
Les effets les plus fréquemment rapportés : bouffées de chaleur, céphalées, sécheresse vaginale, diminution de la libido, trouble de l'humeur et dyspareunie sont liés au blocage hypophyso-ovarien.
L'utilisation prolongée entraîne une perte osseuse, facteur de risque d'une éventuelle ostéoporose.
Dans le cadre d'un traitement de l'endométriose associant ENANTONE à une hormonothérapie de substitution (« add-back therapy »), on note également des métrorragies.
Puberté précoce centrale :
A l'initiation du traitement, une augmentation importante de courte durée du taux d'hormones sexuelles apparaît, suivie d'une diminution jusqu'aux valeurs de la pré-puberté. En raison de ces effets pharmacologiques, des effets indésirables peuvent survenir, particulièrement au début du traitement.
Les effets indésirables rapportés avec une fréquence supérieure ou égale à 0,5% chez des patients recevant de la leuproréline sont listés ci-dessous selon la classification MedDRA (par classe organe et de fréquence absolue). Les fréquences sont définies comme suit : très fréquent (> 1/10), fréquent (> 1/100, < 1/10), peu fréquent (> 1/1 000, < 1/100), rare (> 1/10 000, < 1/1 000), très rare (< 1/10 000), cas isolés, non connus (ne pouvant être estimés à partir des données disponibles).
Affections du système immunitaire:
Très rare: réactions allergiques générales (fièvre, rash, démangeaisons, réactions anaphylactiques).
Affections du système nerveux:
Fréquent: céphalées.
Fréquence inconnue : convulsions.
Comme pour les autres produits de cette classe, de très rares cas d'apoplexie hypophysaire ont été rapportés après une administration chez les patients présentant un adénome hypophysaire.
Affections gastro-intestinales:
Fréquent: douleur abdominale/crampes abdominales, nausées/vomissements.
Affections de la peau et du tissu sous-cutané:
Fréquent: acné.
Peu fréquent: éruption.
Affections vasculaires:
Fréquent: bouffées de chaleur.
Troubles généraux et anomalies au site d'administration:
Fréquent: réaction au point d'injection, inflammation au point d'injection, douleur au point d'injection.
Peu fréquent: induration au point d'injection.
Affections des organes de la reproduction et du sein:
Fréquent: vaginite, métrorragies, sécrétions vaginales.
Peu fréquent: leucorrhées.
Note : en général, l'apparition de saignements vaginaux avec un traitement continu (consécutifs à une possible hémorragie de privation dans le premier mois de traitement) doit être évaluée comme un signe de potentiel sous-dosage. La suppression hypophysaire doit ensuite être confirmée par un test LHRH.
Affections psychiatriques:
Fréquent: instabilité émotionnelle, altération d'humeur, dépression lors des traitements à long terme.
La survenue éventuelle de petites hémorragies génitales après la première injection chez les filles ne justifie l'adjonction d'un traitement freinateur que si celles-ci se poursuivent au delà du premier mois de traitement.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
SURVEILLANCE du traitement :
- Cancer de la prostate :
. La testostéronémie doit être vérifiée périodiquement en cours de traitement ; sa valeur ne devant pas être supérieure à 1 ng/ml.
. La réponse thérapeutique peut être évaluée au niveau osseux par examen scintigraphique; au niveau prostatique, la réponse sera appréciée par l'examen clinique et le toucher rectal; au niveau sanguin par le dosage du PSA.
- Endométriose : il est indispensable de vérifier avant toute prescription, l'absence de grossesse. La survenue de métrorragies doit conduire à la vérification du taux d'estradiol plasmatique et s'il est inférieur à 50 pg/ml, à la recherche d'éventuelles lésions organiques associées.
- Puberté précoce centrale :
. Surveillance de la prise de poids de l’enfant.
. Le traitement doit être arrêté vers l'âge physiologique de la puberté chez les garçons et les filles et il est recommandé de ne pas poursuivre le traitement chez les filles ayant un âge osseux supérieur à 12 ans. Il est recommandé d’arrêter le traitement chez les garçons ayant un âge osseux de 13-14 ans.
Grossesse
Les données actuellement disponibles sur les effets de cette classe de produits au cours de la grossesse sont les suivants:
Chez l'animal, les études effectuées n'ont pas mis en évidence d'effet tératogène. En l'absence d'effet tératogène chez l'animal, un effet malformatif dans l'espèce humaine n'est pas attendu. En effet, à ce jour, les substances responsables de malformations dans l'espèce humaine se sont révélées tératogènes chez l'animal au cours d'études bien conduites sur deux espèces.
En clinique, l'utilisation par mégarde d'analogues de la GnRH, sur des effectifs limités de grossesses exposées, n'a révélé aucun effet malformatif ou foetotoxique particulier à ce jour. Toutefois, des études complémentaires sont nécessaires pour vérifier les conséquences d'une exposition en cours de grossesse.
Cependant, par mesure de précaution, ENANTONE ne devra pas être utilisé chez les femmes enceintes.
Allaitement
En l'absence de données concernant le passage de ce médicament dans le lait et les effets éventuels sur l'enfant nourri au sein, ENANTONE ne devra pas être utilisé en cas d'allaitement.
Une injection sous-cutanée ou intra-musculaire à renouveler tous les 3 mois.
Dans l'indication « Traitement concomitant et adjuvant à la radiothérapie externe dans le cancer de la prostate localement avancé (stade T3-T4 de la classification TNM ou stade C de la classification AUA) », il est recommandé de poursuivre le traitement pendant 3 ans.
Chez les patients traités par analogues de la GnRH pour un cancer de la prostate métastatique, le traitement est généralement maintenu en cas de développement d'un cancer de la prostate résistant à la castration. Il convient de tenir compte des recommandations en vigueur.
Endométriose:
Une injection sous-cutanée ou intra-musculaire à renouveler tous les 3 mois.
Durée: l'endométriose, quel que soit le stade, sera traitée au maximum durant 6 mois.
Toutefois, dans les cas associés à une symptomatologie pelvienne chronique et en l'absence de désir immédiat de grossesse, la durée de traitement peut être portée à un an en associant ENANTONE à une hormonothérapie de substitution (« add-back therapy ») à partir du 3e mois.
Le schéma thérapeutique validé est: ENANTONE en association avec du valérate d'oestradiol micronisé 2 mg par jour administrée par voie orale et de la promégestone 0,5 mg par jour administrée par voie orale.
Il n'est pas souhaitable d'entreprendre une seconde cure par ENANTONE ou par un autre analogue de la GnRH.
Puberté précoce centrale:
Le traitement des enfants par la leuproréline doit se faire sous la surveillance générale d'un endocrino-pédiatre, d'un pédiatre ou d'un endocrinologue ayant une expertise dans le traitement de la puberté précoce centrale.
Le schéma posologique doit être adapté individuellement.
La dose initiale recommandée dépend du poids corporel.
Enfants d'un poids supérieur ou égal à 20 kg :
La dose administrée sera de 2 ml (11,25 mg d'acétate de leuproréline) de suspension reconstituée à partir des 130,0 mg de microcapsules dans 2 ml de solvant, tous les 3 mois, en une seule injection sous-cutanée.
Enfants d'un poids inférieur à 20 kg :
Dans ces rares cas, la dose suivante sera administrée en fonction de l'activité clinique de la puberté précoce centrale :
1 ml (5,625 mg d'acétate de leuproréline) soit la moitié du volume de la suspension reconstituée à partir des 130,0 mg de microcapsules dans 2 ml de solvant, tous les 3 mois, en une seule injection sous-cutanée.
Le reste de la suspension doit être éliminé. La prise de poids de l'enfant doit être surveillée.
Selon l'activité de la puberté précoce centrale, il peut être nécessaire d'augmenter la dose en présence d'une suppression insuffisante (détection clinique par exemple spotting ou suppression gonadotrope insuffisante confirmée par le test LHRH). La dose efficace minimale trimestrielle à administrer doit être déterminée par un test LHRH.
Des abcès stériles au site d'injection apparaissent fréquemment quand la leuproréline est administrée en intramusculaire à des doses supérieures aux doses recommandées. C'est pourquoi, dans ce cas, le médicament doit être administré en sous-cutané (voir rubrique Mises en garde et précautions d'emploi).
Il est recommandé d'utiliser les volumes les plus faibles possible pour l'injection chez l'enfant pour diminuer les désagréments associés à l'injection intramusculaire/sous-cutanée.
La durée du traitement dépend des paramètres cliniques au début du traitement ou pendant le traitement (prévision de la taille finale, vitesse de la croissance, âge osseux et/ou accélération de l'âge osseux) et est décidée en accord avec le pédiatre et le représentant légal et le cas échéant, l'enfant traité. L'âge osseux doit être surveillé pendant le traitement à 6-12 mois d'intervalle.
Chez les filles ayant un âge osseux supérieur à 12 ans et chez les garçons ayant un âge osseux supérieur à 13 ans, l'arrêt du traitement doit être envisagé en prenant en compte les paramètres cliniques.
Chez les filles, une grossesse doit être exclue avant le début du traitement. La survenue d'une grossesse pendant le traitement ne peut pas être exclue. Dans ce cas, un avis médical doit être demandé.
Note :
L'administration doit se faire à intervalle de 90 ± 2 jours pour prévenir la réapparition des symptômes de la puberté précoce.
Durée de conservation :
3 ans.
Après ouverture: le produit doit être utilisé immédiatement.
Précautions particulières de conservation :A conserver à température ambiante, à l'abri de la chaleur.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
Ce solvant est spécifique d'Enantone LP 11,25 mg : il ne devra jamais être remplacé par un autre solvant.
Sans objet.
Classe pharmacothérapeutique : ANALOGUE DE L'HORMONE ENTRAINANT LA LIBERATION DE GONADOTROPHINES, code ATC : L02AE02.
La leuproréline est un nonapeptide de synthèse analogue de la GnRH naturelle. Les études conduites chez l'homme comme chez l'animal ont montré qu'après une stimulation initiale, l'administration prolongée de leuproréline entraîne une diminution de la sécrétion gonadotrope, supprimant les fonctions testiculaires chez l'homme ou entraînant une atrophie du tissu endométrial utérin et ectopique chez la femme. Cet effet est réversible à l'arrêt du traitement.
Une diminution de la sensibilité des récepteurs périphériques à la GnRH a été également évoquée à la suite de certaines études animales. Il s'agit d'un effet direct par diminution de la sensibilité des récepteurs périphériques à la GnRH.
Chez l'homme, après administration de la première dose, il se produit une élévation des taux sanguins de LH et FSH entraînant une augmentation initiale des taux de stéroïdes gonadiques (testostérone et dihydrotestostérone).
La poursuite du traitement entraîne une diminution des taux de LH et FSH conduisant, dans un délai de 4 semaines à une diminution des taux de testostérone qui deviennent équivalents à ceux observés après castration chirurgicale; cet effet persiste aussi longtemps que le produit est administré.
Chez la femme, l'administration prolongée de leuproréline entraîne une suppression de la sécrétion d'estradiol et ainsi une mise au repos du tissu endométriosique.
Dans le cadre du traitement de l'endométriose par ENANTONE combiné à une hormonothérapie de substitution (« add-back therapy »), des données cliniques sur une période thérapeutique de un an ont été obtenues avec le schéma posologique comportant du valérate d'oestradiol micronisé 2 mg par jour administré par voie orale et de la promégestone 0,5 mg par jour administrée par voie orale.
Chez l'enfant, l'inhibition réversible de la libération gonadotrope hypophysaire se manifeste par la diminution consécutive des taux d'estradiol (E2) ou de testostérone proches des valeurs observées à la pré-puberté.
La stimulation gonadique initiale peut être responsable de petites hémorragies génitales chez les filles qui ont déjà leurs règles au début du traitement. Une hémorragie de privation peut apparaître en début de traitement. Les hémorragies s'arrêtent normalement à la poursuite du traitement.
Les effets thérapeutiques suivants peuvent être démontrés :
· suppression des taux de base des gonadotrophines aux taux observés à la pré-puberté
· suppression des taux de l'hormone sexuelle prématurément augmentée aux taux observés à la pré-puberté et arrêt des menstruations prématurées
· arrêt/régression du développement somatique pubertaire (stades de Tanner)
· amélioration/normalisation du ratio de l'âge statural/l'âge osseux
· prévention de l'accélération de l'âge osseux
· baisse de la vitesse de la croissance et sa normalisation
· augmentation de la taille finale
Les résultats du traitement sont la suppression de l'activation pathologique et prématurée de l'axe gonadique hypothalamo hypophysaire avec retour à l'âge pré-pubertaire.
Dans une étude clinique au long cours chez des enfants traités par leuproréline à des doses supérieures à 15 mg par mois pendant plus de 4 ans la reprise de la progression de la puberté a été observée à l'arrêt du traitement. Le suivi de 20 femmes jusqu'à l'âge adulte a montré un cycle menstruel normal chez 80% d'entre elles et 12 grossesses chez 7 des 20 femmes y compris des grossesses multiples pour 4 sujets.
Chez les enfants :
La Figure 1 présente les concentrations sériques de leuproréline pendant les 6 premiers mois de traitement après administration SC d'acétate de leuproréline 3 mois (2 injections). Après la première injection, les concentrations sériques augmentent pour atteindre leur maximum au 4ème mois (294,79 pg/ml ± 105,42) et diminuent légèrement jusqu'au 6ème mois (229,02 pg/ml ± 103,33).
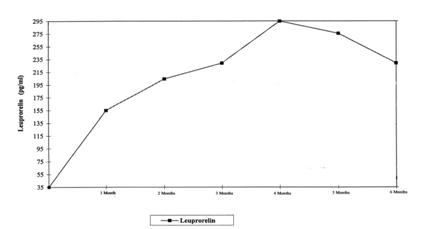
Figure1: concentrations sériques de leuproréline pendant les 6 premiers mois de traitement par acétate de leuproréline 3 mois (2 injections SC) (n=42-43)
Sans objet.
· Mettre le pouce sur le point bleu et casser l'ampoule de solvant en exerçant une flexion à ce niveau ;
POUR LE CONDITIONNEMENT AVEC LES FLACONS DE POUDRE ET DE SOLVANTS SEULS :
· Soutirer le contenu de l'ampoule de solvant à l'aide d'une seringue et l'introduire dans le flacon de poudre pour reconstituer la suspension. Ce solvant est spécifique d'Enantone LP 11,25 mg : il ne devra jamais être remplacé par un autre solvant.
· Bien agiter la préparation.
· Aspirer le mélange obtenu en s'assurant que la totalité de la suspension a bien été soutirée.
· Injecter la suspension immédiatement après la reconstitution à l'aide d'une aiguille S.C. ou I.M.
POUR LE CONDITIONNEMENT AVEC SERINGUES ET AIGUILLES :
· A l'aide de la seringue et de l'aiguille ROSE, soutirer le contenu de l'ampoule de solvant et l'introduire dans le flacon de poudre pour reconstituer la suspension. Ce solvant est spécifique d'ENANTONE LP 11,25 mg: il ne devra jamais être remplacé par un autre solvant.
· Bien agiter la préparation.
· Aspirer le mélange obtenu en s'assurant que la totalité de la suspension a bien été soutirée.
· Changer l'aiguille afin de procéder à l'injection : il conviendra d'utiliser l'aiguille BLEUE pour une injection sous-cutanée et l'aiguille VERTE pour une injection intra-musculaire.
· Injecter la suspension immédiatement après la reconstitution.
· La présence du système de sécurité de l'aiguille est destinée à protéger le personnel soignant contre le risque de piqûre accidentelle.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Absence d'information dans l'AMM.
130 mg de poudre en flacon (verre type I siliconé) de 9 ml, bouchon (butyle), capsule (aluminium), disque de protection (polypropylène) + 2 ml de solvant en ampoule (verre) avec un dispositif d'administration contenant une seringue de 2,5 ml accompagnée de 3 aiguilles (de tailles différentes : 23G (bleue), 21G (verte) et 18G (rose)) avec système de sécurité (safe-system) ; boîte de 1.
