ACIDE ZOLEDRONIQUE MEDAC 4 mg-100 ml, solution pour perfusion, boîte de 1 flacon de 100 ml
Dernière révision : 23/09/2020
Taux de TVA : 2.1%
Prix de vente : 98,27 €
Taux remboursement SS : 65%
Base remboursement SS : 98,27 €
Laboratoire exploitant : MEDAC
- Prévention des complications osseuses (fractures pathologiques, compression médullaire, irradiation ou chirurgie osseuse, hypercalcémie induite par des tumeurs (TIH)) chez les patients adultes atteints d'un cancer avancé avec atteinte osseuse.
- Traitement de l'hypercalcémie induite par des tumeurs chez les patients adultes.
Hypersensibilité á la substance active, à d'autres bisphosphonates ou à l'un des excipients mentionnés à la rubrique Liste des excipients
Allaitement (voir rubrique Fertilité, grossesse et allaitement).
Générales
Les patients devront être évalués avant l'administration d'acide zolédronique pour s'assurer qu'ils sont correctement hydratés.
L'hyperhydratation doit être évitée chez les patients présentant un risque d'insuffisance cardiaque.
Les paramètres métaboliques standards associés à l'hypercalcémie, tels que la calcémie, la phosphatémie et la magnésémie, doivent être surveillés étroitement après l'instauration du traitement par l'acide zolédronique. En cas d'hypocalcémie, d'hypophosphatémie ou d'hypomagnésémie, une supplémentation de courte durée peut être nécessaire. Les patients ayant une hypercalcémie non traitée présentent généralement une atteinte de la fonction rénale ; il est donc recommandé de surveiller avec précaution la fonction rénale.
D'autres médicaments contenant comme substance active l'acide zolédronique sont autorisés dans les indications de l'ostéoporose et de la maladie osseuse de Paget.
Les patients traités par Acide zolédronique medac ne doivent pas être traités de façon concomitante par ces médicaments ou par un autre bisphosphonate, car les effets de ces associations ne sont pas connus.
Insuffisance rénale
Les patients présentant une TIH et des signes d'altération de la fonction rénale doivent être évalués de façon appropriée afin de déterminer le rapport bénéfice/risque du traitement par l'acide zolédronique.
La décision de traiter les patients présentant des métastases osseuses afin de prévenir les complications osseuses devra être prise en tenant compte du fait que l'effet du traitement est observé au bout de 2 à 3 mois.
L'acide zolédronique a été associé à des cas d'altération de la fonction rénale. Les facteurs qui peuvent augmenter le risque d'altération de la fonction rénale sont notamment la déshydratation, une insuffisance rénale préexistante, des cycles multiples d'acide zolédronique 4 mg et d'autres bisphosphonates, et l'administration d'autres médicaments néphrotoxiques. Bien que le risque soit réduit avec la dose de 4 mg administrée en 15 minutes, une altération de la fonction rénale peut cependant survenir. Une altération de la fonction rénale, une progression en insuffisance rénale et la nécessité de dialyses ont été rapportées chez des patients après la première dose ou après une dose unique de 4 mg d'acide zolédronique. Des augmentations de la créatininémie peuvent également survenir, bien que moins fréquemment, chez certains patients qui reçoivent l'acide zolédronique en traitement chronique aux doses recommandées pour la prévention des complications osseuses.
La créatininémie doit être déterminée avant chaque administration d'acide zolédronique. En cas d'instauration du traitement chez des patients ayant des métastases osseuses et une atteinte rénale légère à modérée, des doses plus faibles d'acide zolédronique sont recommandées. En cas d'altération de la fonction rénale au cours du traitement, Acide zolédronique medac devra être interrompu. Acide zolédronique medac ne devra être repris que lorsque la créatininémie sera revenue à la valeur de base ± 10 %. Le traitement par Acide zolédronique medac devra être repris à la même dose que celle administrée avant l'interruption du traitement.
En raison de l'effet potentiel de l'acide zolédronique sur la fonction rénale, du manque de données de sécurité clinique chez les patients présentant, avant le traitement, une insuffisance rénale sévère (définie, dans les études cliniques, par une créatininémie ≥ 400 µmol/l ou ≥ 4,5 mg/dl chez des patients présentant une TIH et par une créatininémie ≥ 265 µmol/l ou ≥ 3,0 mg/dl chez des patients atteints d'un cancer avec métastases osseuses) et compte tenu des données pharmacocinétiques encore limitées chez les patients présentant une insuffisance rénale sévère avant le traitement (clairance de la créatinine < 30 ml/min), l'utilisation d'acide zolédronique n'est pas recommandée chez les patients atteints d'insuffisance rénale sévère.
Insuffisance hépatique
Les données cliniques disponibles étant limitées chez les patients présentant une insuffisance hépatique sévère, aucune recommandation spécifique ne peut être donnée pour cette population de patients.
Ostéonécrose
Ostéonécrose de la mâchoire
Des cas d'ostéonécrose de la mâchoire (ONM) ont été rapportés peu fréquemment dans les études cliniques et dans le cadre de la pharmacovigilance chez des patients recevant l'acide zolédronique. L'expérience après commercialisation et la littérature scientifique suggèrent une fréquence plus importante de signalements d'ONM en fonction du type de tumeur (cancer du sein avancé, myélome multiple). Une étude a montré que l'ONM était plus fréquente chez les patients atteints de myélome par rapport à d'autres cancers (voir rubrique Propriétés pharmacodynamiques).
L'instauration du traitement ou d'une nouvelle cure doit être différée chez les patients présentant des lésions des tissus mous ouvertes non cicatrisées dans la bouche, sauf dans les situations d'urgence médicale. Un examen bucco-dentaire avec des soins dentaires préventifs appropriés et une évaluation individuelle du rapport bénéfice/risque sont recommandés avant le traitement par des bisphosphonates chez les patients présentant des facteurs de risque associés.
Les facteurs de risques suivants doivent être pris en compte lors de l'évaluation du risque individuel de développer une ONM :
Puissance du bisphosphonate (risque plus élevé pour les composés de grande puissance), voie d'administration (risque plus élevé par voie parentérale), et dose cumulée du bisphosphonate.
Cancer, comorbidités (par exemple anémie, coagulopathies, infection), tabagisme.
Traitements concomitants : chimiothérapie, inhibiteurs de l'angiogenèse (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions), radiothérapie de la tête et du cou, corticostéroïdes.
Antécédents de troubles dentaires, mauvaise hygiène buccale, maladie parodontale, soins dentaires invasifs (par exemple extractions dentaires) et prothèses dentaires mal ajustées.
Tous les patients doivent être incités à maintenir une bonne hygiène buccale, à faire réaliser des bilans bucco-dentaires réguliers et à signaler immédiatement tous les symptômes buccaux tels que mobilité dentaire, douleur ou gonflement, ou absence de cicatrisation de lésions ou écoulement pendant le traitement par Acide zolédronique medac. Pendant le traitement, les interventions dentaires invasives ne doivent être réalisées qu'après une évaluation attentive et doivent être évitées pendant les périodes proches de l'administration d'acide zolédronique.
Chez les patients qui développent une ostéonécrose de la mâchoire au cours du traitement par un bisphosphonate, une chirurgie dentaire peut aggraver cette atteinte. Chez les patients nécessitant une intervention dentaire, il n'existe pas de données suggérant que l'arrêt du traitement par le bisphosphonate diminue le risque d'ostéonécrose de la mâchoire.
Le plan de prise en charge des patients qui développent une ONM doit être établi en étroite collaboration entre le médecin traitant et un dentiste ou chirurgien-dentiste expérimenté dans l'ONM.
Si possible, une interruption temporaire du traitement par l'acide zolédronique doit être envisagée jusqu'à la résolution de l'affection et la diminution des facteurs de risque contribuant au développement de l'ONM.
Ostéonécrose d'autres sites anatomiques
L'ostéonécrose du conduit auditif externe a été rapportée avec les bisphosphonates, surtout en association avec une thérapie à long terme. Les facteurs de risque éventuels d'ostéonécrose du conduit auditif externe comprennent l'utilisation de stéroïdes et la chimiothérapie et/ou les facteurs de risque locaux tels qu'une infection ou un traumatisme. La possibilité d'ostéonécrose du conduit auditif externe doit être envisagée chez les patients recevant des bisphosphonates qui présentent des symptômes auditifs, notamment des infections chroniques de l'oreille.
De plus, des cas sporadiques d'ostéonécrose d'autres sites anatomiques ont été rapportés, y compris de la hanche et du fémur, principalement chez les adultes atteints de cancer traités par Acide zolédronique medac.
Douleurs musculo-squelettiques
Dans le cadre de la pharmacovigilance, des douleurs osseuses, articulaires et/ou musculaires sévères et parfois invalidantes ont été rapportées chez des patients traités par des bisphosphonates, y compris l'acide zolédronique. Ces cas n'ont toutefois été rapportés que peu fréquemment. Le délai d'apparition des symptômes varie d'un jour à plusieurs mois après le début du traitement. Chez la majorité des patients, ces symptômes ont régressé après l'arrêt du traitement. Une réapparition des symptômes a été observée chez certains patients après la reprise du traitement avec l'acide zolédronique ou avec un autre bisphosphonate.
Fractures du fémur atypiques
Des fractures fémorales atypiques sous-trochantériennes et diaphysaires ont été rapportées avec les bisphosphonates, principalement chez des patients recevant un traitement au long cours de l'ostéoporose. Ces fractures transverses ou obliques courtes peuvent survenir à tout endroit du fémur, du dessous du petit trochanter jusqu'au-dessus de la tubérosité supracondylienne. Ces fractures surviennent après un traumatisme minime ou en l'absence de traumatisme, et certains patients présentent une douleur dans la cuisse ou l'aine, souvent associée à des signes radiologiques de fractures de stress, des semaines ou des mois avant de présenter une fracture fémorale complète. Les fractures sont souvent bilatérales ; par conséquent, le fémur controlatéral doit être examiné chez les patients traités par des bisphosphonates ayant présenté une fracture de la diaphyse fémorale. Une mauvaise consolidation de ces fractures a été également rapportée. En cas de suspicion de fracture fémorale atypique, l'arrêt du traitement par le bisphosphonate doit être envisagé en attendant l'examen du patient, sur la base du rapport bénéfice/risque pour le patient.
Pendant le traitement par des bisphosphonates, les patients doivent être informés qu'ils doivent signaler toute douleur au niveau de la cuisse, de la hanche ou de l'aine et tous les patients présentant de tels symptômes doivent être examinés pour rechercher une fracture fémorale atypique.
Hypocalcémie
Une hypocalcémie a été rapportée chez des patients traités par l'acide zolédronique. Des arythmies cardiaques et des effets indésirables neurologiques secondaires à des cas d'hypocalcémie sévère (incluant convulsions, hypoesthésie et tétanie) ont été rapportés. Des cas d'hypocalcémie sévère nécessitant une hospitalisation ont été rapportés. Dans certains cas, l'hypocalcémie peut engager le pronostic vital (voir rubrique Effets indésirables).
La prudence est conseillée lorsque l'acide zolédronique est administré en même temps que des médicaments connus pour provoquer une hypocalcémie, car ceux-ci peuvent avoir un effet synergique conduisant à une hypocalcémie sévère (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions). La calcémie doit être mesurée et l'hypocalcémie doit être corrigée avant le début du traitement par acide zolédronique. Les patients doivent recevoir une supplémentation en calcium et en vitamine D adaptée.
Sodium
Zolédronique acide medac contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu'il est essentiellement « sans sodium ».
Résumé du profil de sécurité
Une réaction de phase aiguë, survenant au cours des trois jours suivant l'administration d'acide zolédronique, et se manifestant par des symptômes, incluant douleur osseuse, fièvre, fatigue, arthralgies, myalgies, frissons et arthrite avec gonflement articulaire consécutif, a été rapportée, ces symptômes se résolvent habituellement en quelques jours (voir la description des effets indésirables sélectionnés).
Les risques importants identifiés avec l'acide zolédronique dans les indications autorisées sont les suivants :
Altération de la fonction rénale, ostéonécrose de la mâchoire, réaction de phase aiguë, hypocalcémie, fibrillation auriculaire, anaphylaxie, pneumopathie interstitielle. La fréquence de chacun de ces risques identifiés est présentée dans le Tableau 2.
Liste tabulée des effets indésirables
Les effets indésirables suivants, énumérés dans le Tableau 2, ont été collectés à partir des études cliniques et des rapports de pharmacovigilance, essentiellement après un traitement chronique par l'acide zolédronique 4 mg :
Tableau 2
Les effets indésirables sont présentés par ordre de fréquence décroissante selon la convention suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
| Affections hématologiques et du système lymphatique Fréquent Anémie Peu fréquent Thrombopénie, leucopénie Rare Pancytopénie | |
| Affections du système immunitaire Peu fréquent Rare | Réaction d'hypersensibilité Œdème de Quincke (angioneurotique) |
| Affections psychiatriques Peu fréquent Rare | Anxiété, troubles du sommeil Confusion |
| Affections du système nerveux Fréquent Peu fréquent Très rare | Céphalée Etourdissements, paresthésies, dysgueusie, hypoesthésie, hyperesthésie, tremblements, somnolence Convulsions, hypoesthésie et tétanie (secondairement à l'hypocalcémie) |
| Affections oculaires Fréquent Peu fréquent Rare Très rare | Conjonctivite Vision trouble, sclérite et inflammation orbitale Uvéite Episclérite |
| Affections cardiaques Peu fréquent Rare | Hypertension, hypotension, fibrillation auriculaire, hypotension pouvant entraîner une syncope ou un collapsus cardiovasculaire Bradycardie, arythmie cardiaque (secondairement à l'hypocalcémie) |
| Affections respiratoires, thoraciques et médiastinales Peu fréquent Dyspnée, toux, bronchoconstriction Rare Pneumopathie interstitielle | |
| Affections gastro-intestinales Fréquent Peu fréquent | Nausées, vomissements, diminution de l'appétit Diarrhée, constipation, douleurs abdominales, dyspepsie, stomatite, bouche sèche |
| Affections de la peau et du tissu sous-cutané Peu fréquent | Prurit, éruptions cutanées (y compris éruptions érythémateuses et maculaires), hypersudation |
| Affections musculo-squelettiques et systémiques Fréquent Peu fréquent Très rare | Douleurs osseuses, myalgies, arthralgies, douleur généralisée Spasmes musculaires, ostéonécrose de la mâchoire Ostéonécrose du conduit auditif externe (effets indésirables de la classe des bisphosphonates) et |
| d'autres sites anatomiques y compris le fémur et la hanche |
| Affections du rein et des voies urinaires Fréquent Altération de la fonction rénale Peu fréquent Insuffisance rénale aiguë, hématurie, protéinurie Rare Syndrome de Fanconi acquis |
| Troubles généraux et anomalies au site d'administration Fréquent Fièvre, syndrome pseudo-grippal (incluant fatigue, frissons, malaise et bouffées vasomotrices) Peu fréquent Asthénie, œdème périphérique, réactions au site d'injection (incluant douleur, irritation, tuméfaction, induration), douleur thoracique, prise de poids, choc anaphylactique, urticaire Rare Symptômes de la réaction de phase aiguë : arthrite et gonflement articulaire |
| Investigations Très fréquent Hypophosphatémie Fréquent Augmentation de la créatininémie et de l'urémie, hypocalcémie Peu fréquent Hypomagnésémie, hypokaliémie Rare Hyperkaliémie, hypernatrémie |
Description d'effets indésirables sélectionnés
Altération de la fonction rénale
Des cas d'insuffisance rénale ont été rapportés avec l'acide zolédronique. Dans une analyse combinée des données de sécurité issues des études d'enregistrement de l'acide zolédronique dans la prévention des complications osseuses chez les patients présentant des cancers avancés avec atteinte osseuse, la fréquence des événements indésirables d'insuffisance rénale suspectés d'être liés à l'acide zolédronique (effets indésirables) a été la suivante : myélome multiple (3,2 %), cancer de la prostate (3,1 %), cancer du sein (4,3 %), cancer du poumon et autres tumeurs solides (3,2 %). Les facteurs pouvant majorer le risque de détérioration de la fonction rénale sont la déshydratation, une insuffisance rénale préexistante, des cycles multiples d'acide zolédronique ou d'autres bisphosphonates, ainsi que l'administration concomitante de médicaments néphrotoxiques ou une durée de perfusion plus courte que celle qui est actuellement recommandée. L'altération de la fonction rénale, la progression en insuffisance rénale et la nécessité de dialyses ont été rapportées chez des patients après la première dose ou après une dose unique de 4 mg d'acide zolédronique (voir rubrique Mises en garde spéciales et précautions d'emploi).
Ostéonécrose de la mâchoire
Des cas d'ostéonécrose de la mâchoire ont été rapportés, essentiellement chez des patients atteints d'un cancer et traités par des médicaments qui inhibent la résorption osseuse, tels qu'Acide zolédronique medac (voir rubrique Mises en garde spéciales et précautions d'emploi). Beaucoup de ces patients recevaient également une chimiothérapie et des corticoïdes et présentaient des signes d'infection locale, y compris une ostéomyélite. La majorité des cas concernait des patients atteints d'un cancer et ayant subi une extraction dentaire ou d'autres interventions de chirurgie dentaire.
Fibrillation auriculaire
Au cours d'une étude de 3 ans, randomisée, contrôlée en double aveugle, qui a évalué l'efficacité et la sécurité de l'acide zolédronique 5 mg administré une fois par an versus placebo dans le traitement de l'ostéoporose post-ménopausique (OPM), l'incidence globale de fibrillation- auriculaire- a été de 2,5 % (96 sur 3 862) dans le bras acide zolédronique 5 mg et de 1,9 % (75 sur 3 852) dans le bras placebo. Le taux de fibrillations auriculaires classées comme évènements indésirables graves a été de 1,3 % (51 sur 3 862) dans le bras acide zolédronique 5 mg et de 0,6 % (22 sur 3 852) dans le bras placebo. Le déséquilibre observé dans cette étude n'a pas été observé dans d'autres études de l'acide zolédronique, y compris celles menées avec l'acide zolédronique 4 mg administré toutes les 3-4 semaines chez des patients atteints d'un cancer. Le mécanisme de l'augmentation de cette incidence de fibrillation auriculaire dans cette seule étude clinique n'est pas connu.
Réaction de phase aiguë
Cet effet indésirable consiste en une constellation de symptômes qui incluent fièvre, myalgies, céphalées, douleurs dans les extrémités, nausées, vomissements, diarrhée, arthralgies et arthrite avec gonflement articulaire consécutif. Les symptômes apparaissent dans les 3 jours suivant la perfusion d'acide zolédronique. La réaction est également désignée par les termes de symptômes « pseudo- grippaux » ou « post-dose ».
Fractures atypiques du fémur
Après la commercialisation, les effets indésirables suivant ont été rapportés (fréquence rare) : fractures fémorales atypiques sous-trochantériennes et diaphysaires (effets indésirables de classe des bisphosphonates).
Effets indésirables liés à l'hypocalcémie
L'hypocalcémie est un risque important identifié avec l'acide zolédronique dans ses indications approuvées. La revue des cas d'hypocalcémie issus des essais cliniques et des cas d'hypocalcémie rapportés depuis la mise sur le marché apporte suffisamment de preuves pour établir le lien entre le traitement par l'acide zolédronique, la survenue d'une hypocalcémie et l'apparition d'une arythmie cardiaque secondaire. De même, il existe des preuves d'une association entre l'hypocalcémie et des effets neurologiques secondaires rapportés dans ces cas, incluant : convulsions, hypoesthésie et tétanie (voir rubrique Mises en garde spéciales et précautions d'emploi).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V.
SURVEILLANCE du traitement :
- calcémie, phosphatémie, magnésémie,
- fonction rénale (mesurer notamment la créatinémie avant chaque administration).
LA SUBSTANCE ACTIVE CONTENUE dans ce produit est identique à celle d'autres spécialités à base d'acide zoledronique. Les patients traités par ce produit ne doivent pas être traités par d'autres biphosphonates de manière concomitante.
- calcémie, phosphatémie, magnésémie,
- fonction rénale (mesurer notamment la créatinémie avant chaque administration).
LA SUBSTANCE ACTIVE CONTENUE dans ce produit est identique à celle d'autres spécialités à base d'acide zoledronique. Les patients traités par ce produit ne doivent pas être traités par d'autres biphosphonates de manière concomitante.
INFORMER LE PATIENT du risque de survenue de fractures atypiques rares du fémur.
Examiner les deux membres inférieurs si une fracture atypique est suspectée.
La décision de traiter les patients ayant des métastases osseuses afin de prévenir les complications osseuses devra être prise en tenant compte du fait que le délai d’action du traitement est de 2 à 3 mois.
BOIRE suffisamment d’eau avant et après chaque administration afin de prévenir une déshydratation.
PREVENIR LE DENTISTE du traitement par ce médicament en cas d'intervention ou de soins dentaires.
PREVENIR LE MEDECIN IMMEDIATEMENT en cas de : - Crampes musculaires, sécheresse de la peau, convulsions ou sensation de brûlure. - Des irrégularités du rythme cardiaque (fibrillation auriculaire). - Réaction allergique sévère : essoufflement, gonflement principalement du visage et de la gorge.
MAINTENIR une bonne hygiène buccale.
FAIRE des bilans dentaires réguliers.
- Douleur au niveau de la bouche, des dents et/ou de la mâchoire, gonflement ou plaies au niveau de la bouche, engourdissement ou sensation de lourdeur de la mâchoire, ou si une dent devient mobile.
- Douleur au niveau de la cuisse, de la hanche ou de l'aine.
PREVENIR LE MEDECIN en cas de douleur, d'écoulement ou d'infection de l'oreille.
PRUDENCE en cas de conduite de véhicules ou d'utilisation de machines (vertiges et somnolence).
Grossesse
Il n'existe pas de données suffisamment pertinentes concernant l'utilisation de l'acide zolédronique chez la femme enceinte. Des études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction (voir rubrique Données de sécurité préclinique). Le risque potentiel en clinique n'est pas connu. L'acide zolédronique ne doit pas être utilisé pendant la grossesse. Il doit être conseillé aux femmes en âge de procréer d'éviter une grossesse.
Allaitement
On ne sait pas si l'acide zolédronique est excrété dans le lait maternel. L'acide zolédronique est contre-indiqué pendant l'allaitement (voir rubrique Contre-indications).
Fertilité
Les effets délétères potentiels de l'acide zolédronique sur la fertilité des parents et de la génération F1 ont été évalués chez le rat. Il a été observé des effets pharmacologiques majorés considérés comme étant liés à l'inhibition du métabolisme du calcium osseux par le médicament, résultant en une hypocalcémie péri-parturiente, un effet de classe des bisphosphonates, une dystocie et un arrêt anticipé de l'étude. Ainsi il n'a pas été possible d'éliminer un effet de l'acide zolédronique sur la fertilité chez l'être humain.
Au cours des études cliniques, l'acide zolédronique a été administré de façon concomitante avec des agents anticancéreux, des diurétiques, des antibiotiques et des analgésiques couramment utilisés sans survenue d'interactions cliniquement significatives. In vitro, l'acide zolédronique ne présente pas de liaison notable aux protéines plasmatiques et n'inhibe pas les enzymes du cytochrome P450 humain (voir rubrique Propriétés pharmacocinétiques), mais aucune étude clinique d'interaction formelle n'a été réalisée.
La prudence est recommandée lorsque les bisphosphonates sont administrés avec des aminosides, la calcitonine ou des diurétiques de l'anse, car ces substances peuvent avoir un effet additif, entraînant une diminution de la calcémie pendant des périodes plus longues que celles requises (voirrubrique Mises en garde et précautions d'emploi).
La prudence s'impose en cas d'administration d'acide zolédronique avec d'autres médicaments potentiellement néphrotoxiques. La survenue possible d'une hypomagnésémie pendant le traitement doit également être prise en compte.
Chez les patients atteints d'un myélome multiple, le risque d'altération de la fonction rénale peut être majoré lorsque l'acide zolédronique est utilisé en association avec la thalidomide.
La prudence est recommandée lorsque l'acide zolédronique est administré avec des médicaments anti- angiogéniques puisqu'une augmentation de l'incidence des ONM a été observée chez des patients traités de façon concomitante par ces médicaments.
Acide zolédronique medac ne doit être prescrit et administré aux patients que par des professionnels de santé ayant l'expérience de l'administration des bisphosphonates par voie intraveineuse. La notice et la carte d'information des patients doivent être remises aux patients traités par Acide zolédronique medac.
Posologie
Prévention des complications osseuses chez les patients atteints d'un cancer avancé avec atteinte osseuse
Adultes et personnes âgées :
La dose recommandée dans la prévention des complications osseuses chez les patients atteints d'un cancer avancé avec atteinte osseuse est de 4 mg d'acide zolédronique toutes les 3 à 4 semaines.
Les patients devront aussi recevoir, par voie orale, un apport de 500 mg de calcium et de 400 UI de vitamine D par jour.
La décision de traiter les patients présentant des métastases osseuses afin de prévenir les complications osseuses devra être prise en tenant compte du fait que le délai d'action du traitement est de 2 à 3 mois.
Traitement de l'hypercalcémie induite par des tumeurs
Adultes et personnes âgées :
La dose recommandée dans l'hypercalcémie (calcémie corrigée en fonction de l'albuminémie ≥ 12,0 mg/dl ou 3,0 mmol/l) est une dose unique de 4 mg d'acide zolédronique.
Insuffisance rénale
TIH :
Chez les patients présentant une hypercalcémie induite par des tumeurs et une insuffisance rénale sévère, le traitement par l'acide zolédronique ne doit être envisagé qu'après évaluation des risques et bénéfices du traitement. Dans les études cliniques, les patients ayant une créatininémie > 400 µmol/l ou > 4,5 mg/dl ont été exclus. Aucune adaptation de la dose n'est nécessaire chez les patients présentant une TIH avec une créatininémie < 400 µmol/l ou < 4,5 mg/dl (voir rubrique Mises en garde et précautions d'emploi).
Prévention des complications osseuses chez des patients atteints d'un cancer avancé avec atteinte osseuse :
La créatininémie et la clairance de la créatinine (ClCr ) doivent être déterminées lors de l'instauration du traitement par l'acide zolédronique chez les patients présentant un myélome multiple ou des métastases osseuses de tumeurs solides. La CLcr est calculée selon la formule de Cockcroft-Gault à partir de la créatininémie. L'acide zolédronique n'est pas recommandé chez les patients présentant, avant l'instauration du traitement, une insuffisance rénale sévère, définie par une CLcr < 30 ml/min pour cette population. Dans les études cliniques, les patients ayant une créatininémie > 265 µmol/l ou 3,0 mg/dl étaient exclus.
Chez les patients ayant une fonction rénale normale (définie comme une CLcr > 60 ml/min), l'acide zolédronique 4 mg/100 ml solution pour perfusion peut être administré directement sans préparation supplémentaire. Chez les patients présentant des métastases osseuses et une insuffisance rénale légère à modérée avant l'instauration du traitement, définie par une CLcr de 30 à 60 ml/min pour cette population, la dose recommandée d'acide zolédronique est la suivante (voir également rubrique Mises en garde et précautions d'emploi) :
| Clairance à la créatinine initiale (ml/min) | Dose recommandée d'acide zolédronique* |
| > 60 50-60 40-49 30-39 |
4,0 mg 3,5 mg* 3,3 mg* 3,0 mg* |
* Les doses ont été calculées en vue d'atteindre une valeur de l'ASC de 0,66 (mg•h/l) (pour une CLcr = 75 ml/min). L'objectif étant que, chez les patients présentant une insuffisance rénale, les doses réduites permettent d'obtenir la même ASC que celle observée chez les patients ayant une clairance à la créatinine de 75 ml/min.
Après l'instauration du traitement, la créatininémie doit être déterminée avant chaque administration d'acide zolédronique et le traitement doit être suspendu si la fonction rénale s'est détériorée. Dans les études cliniques, la détérioration de la fonction rénale était définie comme suit :
augmentation de 0,5 mg/dl ou 44 µmol/l chez les patients qui avaient une créatininémie initiale normale (< 1,4 mg/dl ou < 124 µmol/l)
augmentation de 1,0 mg/dl ou 88 µmol/l chez les patients qui avaient une créatininémie initiale anormale (> 1,4 mg/dl ou > 124 µmol/l).
Dans les études cliniques, le traitement par l'acide zolédronique n'était repris que lorsque la valeur de la créatininémie était revenue à la valeur initiale ± 10 % (voir rubrique Mises en garde et précautions d'emploi). Le traitement par l'acide zolédronique devra être repris à la même dose que celle administrée avant l'interruption du traitement.
Population pédiatrique
La sécurité et l'efficacité de l'acide zolédronique chez les enfants âgés de 1 an à 17 ans n'ont pas été établies. Les données actuellement disponibles sont décrites à la rubrique Propriétés pharmacodynamiques, mais aucune recommandation sur la posologie ne peut être donnée.
Mode d'administration
Voie intraveineuse.
Acide zolédronique medac 4 mg/100 ml solution pour perfusion doit être administré en une perfusion intraveineuse unique d'au moins 15 minutes.
Chez les patients ayant une fonction rénale normale, fonction définie par une Clcr > 60 ml/min, l'acide zolédronique 4 mg/100 ml solution pour perfusion ne doit pas être dilué.
Chez les patients présentant une atteinte rénale légère à modérée, des doses réduites d'Acide zolédronique medac 4 mg/100 ml solution pour perfusion sont recommandées (voir rubrique « Posologie » ci-dessus et rubrique Mises en garde et précautions d'emploi).
Pour préparer les doses réduites pour les patients ayant une Clcr initiale ≤ 60 ml/min, se reporter au Tableau 1 ci-dessous.
Retirer du flacon le volume indiqué de solution d'Acide zolédronique medac 4 mg/100 ml et le remplacer par un volume égal de solution injectable stérile de chlorure de sodium 9 mg/ml (0,9 %) ou de solution injectable stérile de glucose à 5 %.
Tableau 1 : Préparation de doses réduites d'acide zolédronique medac 4 mg/100 ml solution pour perfusion
| Clairance de la créatinine initiale (ml/min) | Retirer le volume suivant d'Acide zolédronique medac solution pour perfusion (ml) | Le remplacer par le volume suivant de solution injectable stérile de chlorure de sodium 9 mg/ml (0,9 %) ou de glucose à 5 % (ml) | Dose ajustée (mg d'acide zolédronique dans 100 ml) |
| 50-60 | 12.0 | 12.0 | 3.5 |
| 40-49 | 18.0 | 18.0 | 3.3 |
| 30-39 | 25.0 | 25.0 | 3.0 |
Acide zolédronique medac 4 mg/100 ml solution pour perfusion ne doit pas être mélangé avec d'autres solutions pour perfusion et doit être administré en solution intraveineuse seule par une ligne de perfusion séparée.
Les patients doivent être correctement hydratés avant et après l'administration de l'acide zolédronique.
Durée de conservation :
Flacon non ouvert : 3 ans.
Après première ouverture : la stabilité physico-chimique de la solution après dilution a été démontrée pendant 4 jours à 2°C-8°C et 25°C.
La stabilité physico-chimique de la solution après première ouverture a été démontrée pendant 96 heures à 2°C-8°C et 25°C pour les flacons en verre, les lignes et poches à perfusion en polyéthylène, chlorure de polyvinyle et polypropylène (préremplis d'une solution injectable de chlorure de sodium 9 mg/ml [0,9 %] ou de glucose à 5 % p/v).
Après première ouverture et dilution : d'un point de vue microbiologique, le médicament doit être utilisé immédiatement. Dans le cas contraire, la durée et les conditions de conservation avant utilisation relèvent de la responsabilité de l'utilisateur et ne doivent pas excéder 24 h à une température comprise entre 2°C et 8°C, sauf si la dilution a été effectuée dans des conditions d'asepsie contrôlées et validées.
Précautions particulières de conservation :
Ne pas congeler.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique Durée de conservation.
Ce médicament ne doit pas entrer en contact avec des solutions contenant du calcium et ne doit pas être mélangé ou administré par voie intraveineuse avec un autre médicament par la même ligne de perfusion.
L'expérience clinique d'un surdosage aigu d'acide zolédronique est limitée. L'administration par erreur de doses d'acide zolédronique allant jusqu'à 48 mg a été rapportée. Les patients ayant reçu des doses supérieures à celles recommandées (voir rubrique Posologie et mode d'administration) doivent être surveillés étroitement, car une altération de la fonction rénale (y compris une insuffisance rénale) et des anomalies des électrolytes sériques (dont calcium, phosphore et magnésium) ont été observées. En présence d'une hypocalcémie, des perfusions de gluconate de calcium doivent être administrées en fonction de la nécessité clinique.
Classe pharmacothérapeutique : Médicaments pour le traitement de maladies osseuses, bisphosphonates, Code ATC : M05BA08
Mécanisme d'action
L'acide zolédronique appartient à la classe des bisphosphonates et agit principalement sur l'os. Il inhibe la résorption osseuse par les ostéoclastes.
L'action sélective des bisphosphonates sur l'os découle de leur affinité élevée pour l'os minéralisé, mais le mécanisme moléculaire précis entraînant l'inhibition de l'activité ostéoclastique n'est pas élucidé. Dans les études à long terme menées chez l'animal, l'acide zolédronique inhibe la résorption osseuse sans effet délétère sur la formation, la minéralisation ou les propriétés mécaniques de l'os.
En plus d'être un puissant inhibiteur de la résorption osseuse, l'acide zolédronique possède également plusieurs propriétés antitumorales qui pourraient contribuer à son efficacité globale dans le traitement des métastases osseuses. Les propriétés suivantes ont été démontrées dans des études précliniques :
In vivo : inhibition de la résorption osseuse par les ostéoclastes, ce qui altère le microenvironnement médullaire, en le rendant moins favorable à la croissance des cellules tumorales, activité anti-angiogénique et activité antalgique.
In vitro : inhibition de la prolifération ostéoblastique, activité cytostatique et pro-apoptotique directe sur les cellules tumorales, effet cytostatique synergique en association à d'autres médicaments anti-cancéreux, activité anti-adhésion/invasion cellulaire.
Efficacité et sécurité cliniques
Résultats des études cliniques dans la prévention des complications osseuses chez des patients atteints d'un cancer avancé avec atteinte osseuse :
La première étude randomisée, en double aveugle, contrôlée versus placebo visait à comparer l'acide zolédronique 4 mg au placebo dans la prévention des complications osseuses (Skeletal Related Events , SRE) chez des patients présentant un cancer de la prostate. L'acide zolédronique 4 mg a réduit significativement le pourcentage de patients présentant au moins une complication osseuse (SRE), a prolongé de plus de 5 mois le délai médian de survenue de la première complication osseuse et a réduit l'incidence annuelle de complications osseuses par patient (taux de morbidité osseuse).
L'analyse des « événements multiples » a montré une réduction de 36 % du risque de développer des SRE dans le groupe acide zolédronique 4 mg par rapport au groupe placebo. Les patients recevant l'acide zolédronique 4 mg ont rapporté une augmentation moindre de la douleur que ceux ayant reçu le placebo, avec des différences significatives à 3, 9, 21 et 24 mois. Les patients présentant des fractures pathologiques ont été moins nombreux dans le groupe traité par l'acide zolédronique 4 mg. Les effets du traitement ont été moins prononcés chez les patients présentant des lésions blastiques. Les résultats d'efficacité sont présentés dans le Tableau 3.
Dans une deuxième étude menée chez des patients atteints de tumeurs solides autres qu'un cancer du sein ou de la prostate, l'acide zolédronique 4 mg a réduit significativement le pourcentage de patients présentant au moins une SRE, a prolongé de plus de 2 mois le délai médian de survenue de la première complication osseuse et a réduit le taux de morbidité osseuse. L'analyse des « événements multiples » a montré une réduction de 30,7 % du risque de développer des SRE dans le groupe acide zolédronique 4 mg par rapport au placebo. Les résultats d'efficacité sont présentés dans le Tableau 4.
Tableau 3 : Résultats d'efficacité (Patients présentant un cancer de la prostate et recevant une hormonothérapie)
Toutes complications osseuses (TIH incluse) Fractures* Radiothérapie osseuse
Acide zolédronique 4 mg Placebo Acide zolédronique 4 mg Placeb o Acide zolédronique 4 mg Placebo N 214 208 214 208 214 208 Pourcentage de patients ayant présenté des SRE (%) 38 49 17 25 26 33 Valeur P 0,028 0,052 0,119 Délai médian jusqu'à la première SRE (jours) 488 321 NA NA NA 640 Valeur P 0,009 0,020 0,055 Taux de morbidité osseuse 0,77 1,47 0,20 0,45 0,42 0,89 Valeur P 0,005 0,023 0,060 Réduction du risque de développer des complications osseuses multiples** (%) 36 - NApp NApp NApp NApp Valeur P 0,002 NApp Napp * Incluant les fractures vertébrales et non vertébrales
** Prend en compte toutes les complications osseuses, le nombre total et le délai jusqu'à chaque événement pendant l'étude
NA = Non atteint NApp = Non applicable
Tableau 4 : Résultats d'efficacité (Patients présentant des tumeurs solides autres que cancer du sein ou cancer de la prostate)
Toutes complications osseuses (TIH incluse) Fractures* Radiothérapie osseuse
Acide zolédronique 4 mg Placebo Acide zolédronique 4 mg Placebo Acide zolédronique 4 mg Placebo N 257 250 257 250 257 250 Pourcentage de patients ayant présenté des SRE (%) 39 48 16 22 29 34 Valeur P 0,039 0,064 0,173 Délai médian jusqu'à la première SRE (jours) 236 155 NA NA 424 307 Valeur P 0,009 0,020 0,079 Taux de morbidité osseuse 1,74 2,71 0,39 0,63 1,24 1,89 Valeur P 0,012 0,066 0,099 Réduction du risque de développer des complications osseuses multiples** (%) 30,7 - NApp NApp NApp NApp Valeur P 0,003 NApp NApp * Incluant les fractures vertébrales et non vertébrales
** Prend en compte toutes les complications osseuses, le nombre total et le délai jusqu'à chaque événement pendant l'étude
NA = Non atteint NApp = Non applicable
Dans une troisième étude de phase III, randomisée en double aveugle, l'acide zolédronique 4 mg et le pamidronate 90 mg administrés toutes les 3 à 4 semaines ont été comparés chez des patients présentant un myélome multiple ou un cancer du sein avec au moins une lésion osseuse. Les résultats ont démontré que l'efficacité de l'acide zolédronique 4 mg était comparable à celle du pamidronate 90 mg dans la prévention des SRE. L'analyse des « événements multiples » a montré une réduction significative de 16 % du risque de développer des complications osseuses chez les patients traités par l'acide zolédronique 4 mg par rapport aux patients traités par le pamidronate. Les résultats d'efficacité sont présentés dans le Tableau 5.
Tableau 5 : Résultats d'efficacité (patients présentant un cancer du sein ou un myélome multiple)
Toutes complications osseuses (TIH incluse) Fractures* Radiothérapie osseuse
Acide zolédronique 4 mg Pamidro- nate 90 mg Acide zolédronique 4 mg Pami- dronat e 90 mg Acide zolédronique 4 mg Pami- dronat e 90 mg N 561 555 561 555 561 555 Pourcentage de patients ayant présenté des SRE (%) 48 52 37 39 19 24 Valeur P 0,198 0,653 0,037 Délai médian jusqu'à la première SRE (jours) 376 356 NA 714 NA NA Valeur P 0,151 0,672 0,026 Taux de morbidité osseuse 1,04 1,39 0,53 0,60 0,47 0,71 Valeur P 0,084 0,614 0,015 Réduction du risque de développer des complications osseuses multiples** (%) 16 - NApp NApp NApp NApp Valeur P 0,030 NApp NApp Incluant les fractures vertébrales et non vertébrales
** Prend en compte toutes les complications osseuses, le nombre total et le délai jusqu'à chaque événement pendant l'étude
NA = Non atteint NApp = Non applicable
L'acide zolédronique 4 mg a également été étudié dans une étude randomisée, en double aveugle, contrôlée versus placebo, menée chez 228 patientes présentant des métastases osseuses documentées d'un cancer du sein, pour évaluer l'effet de l'acide zolédronique 4 mg sur l'incidence des complications osseuses (Skeletal Related Events, SRE), calculé comme le nombre total de SRE (excluant l'hypercalcémie et ajusté en fonction des fractures antérieures) sur le temps d'exposition au risque. Les patientes ont reçu 4 mg l'acide zolédronique ou le placebo toutes les 4 semaines pendant un an. La répartition des patientes entre le groupe traité par l'acide zolédronique et le groupe placebo était homogène.
L'incidence de SRE (événement/année-patient) a été de 0,628 pour l'acide zolédronique et de 1,096 pour le placebo. Le pourcentage de patientes ayant présenté au moins une SRE (en excluant l'hypercalcémie) a été de 29,8 % dans le groupe traité par l'acide zolédronique versus 49,6 % dans le groupe placebo (P = 0,003). Le délai médian jusqu'à la première SRE n'était pas encore atteint dans le groupe acide zolédronique à la fin de l'étude et était significativement prolongé par rapport au placebo (P = 0,007). Dans une analyse des « événements multiples », l'acide zolédronique 4 mg a réduit de 41 % le risque de SRE par rapport au placebo (risque relatif = 0,59, P = 0,019).
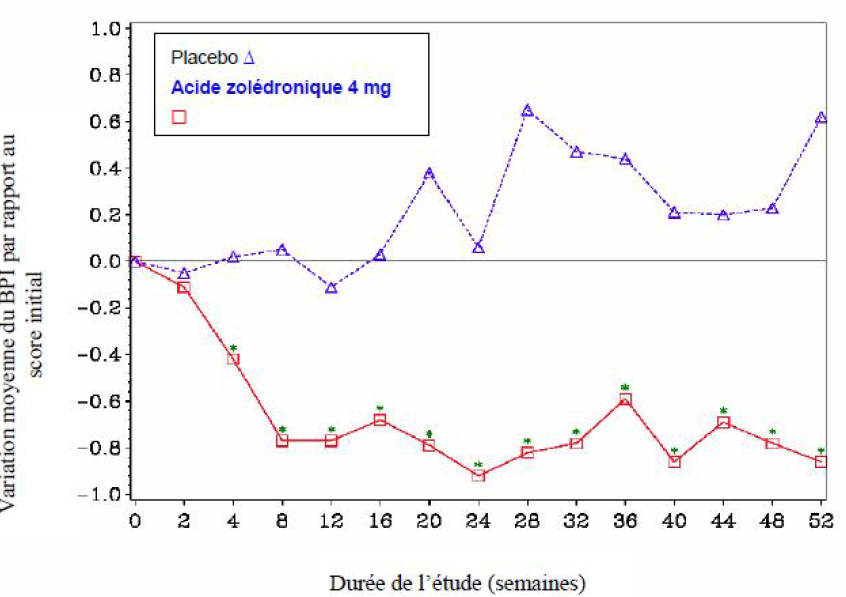
Dans le groupe acide zolédronique, une amélioration statistiquement significative des scores de douleur (calculés à l'aide du Brief Pain Inventory, BPI) a été observée à la semaine 4 et lors de tous les temps d'évaluation ultérieurs de l'étude par rapport au placebo (Figure 1). Le score de douleur avec l'acide zolédronique a été constamment inférieur au score initial et la réduction de la douleur a été accompagnée d'une tendance à la réduction du score d'analgésie.
Figure 1 : Variations moyennes du score de douleur BPI par rapport au score initial. Pour la comparaison des traitements (4 mg d'acide zolédronique versus placebo), les différences statistiquement significatives sont annotées d'un astérisque (*P < 0,05)
Étude CZOL446EUS122/SWOG
L'objectif principal de cette étude observationnelle était d'estimer l'incidence cumulative de l'ostéonécrose de la mâchoire (ONM) à 3 ans chez des patients cancéreux atteints de cancer avec métastases osseuses recevant de l'acide zolédronique. La thérapie d'inhibition des ostéoclastes, d'autres thérapies contre le cancer, et les soins dentaires ont été effectués conformément à la situation clinique afin de représenter au mieux les soins académiques et communautaires. Un bilan buccodentaire a été recommandé mais n'était pas obligatoire.
Parmi les 3491 patients évaluables, 87 cas de diagnostic d'ONM ont été confirmés. L'incidence cumulée globale estimée des ONM confirmées à 3 ans était de 2,8% (IC à 95% : 2,3-3,5%). Les taux étaient de 0,8% à l'année 1 et de 2,0% à l'année 2. Les taux d'ONM confirmées à 3 ans étaient plus élevés chez les patients atteints d'un myélome (4,3%) et plus faibles chez les patients atteints d'un cancer du sein (2,4%). Les cas d'ONM confirmées étaient significativement plus important sur le plan statistique chez les patients atteints de myélome multiple (p=0,03) que les autres cancers combinés.
Résultats des études cliniques dans le traitement de l'hypercalcémie induite par des tumeurs
Les études cliniques menées dans l'hypercalcémie induite par des tumeurs (TIH) ont démontré que l'effet de l'acide zolédronique est caractérisé par une diminution de la calcémie et de l'excrétion urinaire de calcium. Dans les études de phase I de détermination de dose menées chez des patients présentant une TIH légère à modérée, les doses efficaces testées ont été dans l'intervalle de 1,2 à 2,5 mg environ.
Pour évaluer les effets de 4 mg d'acide zolédronique versus pamidronate 90 mg, les résultats de deux études pivots multicentriques chez des patients présentant une TIH ont été combinés dans une analyse préalablement programmée. Il a été observé une normalisation de la calcémie corrigée plus rapide au 4e jour avec 8 mg d'acide zolédronique et au 7e jour avec 4 mg et 8 mg d'acide zolédronique. Les taux de réponse observés ont été les suivants :
Tableau 6 : Pourcentage de patients ayant obtenu une réponse complète par jour dans les études de la TIH combinées :
4e jour 7e jour 10e jour Acide zolédronique 4 mg (n = 86) 45,3 % (P = 0,104) 82,6 % (P = 0,005)* 88,4 % (P = 0,002)* Acide zolédronique 8 mg (n = 90) 55,6 % (P = 0,021)* 83,3 % (P = 0,010)* 86,7 % (P = 0,015)* Pamidronate 90 mg (n = 99) 33,3 % 63,6 % 69,7 % *valeurs P versus pamidronate. Le délai médian de normalisation de la calcémie a été de 4 jours. Le délai médian jusqu'à la rechute (nouvelle augmentation de la calcémie corrigée ≥ 2,9 mmol/l) a été de 30 à 40 jours chez les patients traités par l'acide zolédronique versus 17 jours chez les patients traités par le pamidronate 90 mg
(P = 0,001 pour 4 mg et P = 0,007 pour 8 mg d'acide zolédronique). Il n'y a pas eu de différence statistiquement significative entre les deux doses d'acide zolédronique.
Dans les études cliniques, 69 patients, qui avaient rechuté ou qui étaient réfractaires au traitement initial (acide zolédronique 4 mg, 8 mg ou pamidronate 90 mg), ont été traités à nouveau avec 8 mg d'acide zolédronique. Le taux de réponse chez ces patients a été d'environ 52 %. Ces patients ayant été traités à nouveau avec la dose de 8 mg d'acide zolédronique seulement, il n'y a pas de données disponibles permettant une comparaison avec la dose de 4 mg.
Dans les études cliniques menées chez des patients présentant une hypercalcémie induite par des tumeurs (TIH), le profil de sécurité global dans les trois groupes de traitement (acide zolédronique 4 mg et 8 mg et pamidronate 90 mg) a été similaire en termes de type et de sévérité des effets indésirables.
Population pédiatrique
Résultats des études cliniques dans le traitement de l'ostéogénèse imparfaite sévère chez des enfants et adolescents âgés de 1 à 17 ans
Les effets de l'acide zolédronique administré par voie intraveineuse chez des enfants et adolescents (âgés de 1 à 17 ans) atteints d'ostéogenèse imparfaite sévère (types I, III, et IV) ont été comparés à ceux du pamidronate administré par voie intraveineuse dans une étude internationale, multicentrique, randomisée en ouvert, avec respectivement 74 et 76 patients dans chaque groupe de traitement. La durée du traitement était de 12 mois et précédée d'une période de sélection de 4 à 9 semaines pendant laquelle une supplémentation en vitamine D et en calcium a été administrée pendant au moins 2 semaines. Dans le programme clinique, les patients âgés de 1 à 3 ans ont reçu 0,025 mg/kg d'acide zolédronique (jusqu'à une dose unique maximale de 0,35 mg) tous les 3 mois et les patients âgés de 3 à 17 ans ont reçu 0,05 mg/kg d'acide zolédronique (jusqu'à une dose unique maximale de 0,83 mg) tous les 3 mois. Une étude d'extension a été menée afin d'examiner la sécurité générale et rénale à long terme de l'acide zolédronique administré une ou deux fois par an pendant la phase d'extension de 12 mois de traitement chez les enfants qui avaient terminé le traitement d'un an par l'acide zolédronique ou par le pamidronate dans l'étude principale.
L'objectif principal de l'étude était le pourcentage de variation de la densité minérale osseuse (DMO) au rachis lombaire après 12 mois de traitement par rapport au début de l'étude. Les effets estimés des traitements sur la DMO ont été similaires, mais la méthodologie de l'étude n'était pas suffisamment robuste pour établir la non-infériorité d'efficacité de l'acide zolédronique. En particulier, il n'a pas été clairement démontré une efficacité sur l'incidence de fractures ou sur la douleur. Des fractures des os longs des membres inférieurs ont été rapportées chez environ 24 % (fémur) et 14 % (tibia) des patients atteints d'ostéogenèse imparfaite sévère traités par l'acide zolédronique versus 12 % et 5 % des patients traités par le pamidronate, quels que soient le type de pathologie et la causalité, mais l'incidence globale de fractures a été comparable chez les patients traités par l'acide zolédronique etpar le pamidronate : 43 % (32/74) versus 41 % (31/76). L'interprétation du risque de fracture est biaisée par le fait que les fractures sont des événements fréquents chez les patients atteints d'ostéogenèse imparfaite sévère, du fait de la maladie.
Les types d'effets indésirables observés dans cette population ont été généralement similaires à ceux observés antérieurement chez des adultes présentant un cancer avancé avec atteinte osseuse (voir rubrique Effets indésirables). Les effets indésirables sont présentés dans le Tableau 7 selon un ordre de fréquence décroissante en utilisant la convention suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 7 : Effets indésirables observés chez des enfants et adolescents atteints d'ostéogenèse imparfaite sévère 1
Affections du système nerveux Fréquent Céphalées Affections cardiaques Fréquent Tachycardie Affections respiratoires, thoraciques et médiastinales Fréquent Rhino-pharyngite Affections gastro-intestinales Très fréquent Fréquent Nausées, vomissements Douleurs abdominales Affections musculo-squelettiques et systémiques Fréquent Douleurs des extrémités, arthralgies, douleurs musculo-squelettiques Troubles généraux et anomalies au site d'administration Très fréquent Fièvre, fatigue Fréquent Réaction de phase aiguë, douleurs Investigations Très fréquent Fréquent Hypocalcémie Hyphophosphatémie 1 Les effets indésirables survenant à une fréquence < 5 % ont été médicalement évalués et il a été démontré que ces cas concordent avec le profil de sécurité bien établi de l'acide zolédronique (voir rubrique Effets indésirables).
Chez les patients pédiatriques atteints d'ostéogenèse imparfaite sévère, l'acide zolédronique semble être associé à des risques plus prononcés de réaction de phase aiguë, d'hypocalcémie et de tachycardie inexpliquée, par rapport au pamidronate, mais cette différence diminue après plusieurs perfusions.
L'Agence européenne des médicaments a accordé une dérogation à l'obligation de soumettre les résultats d'études réalisées avec le médicament de référence contenant l'acide zolédronique dans tous les sous-groupes de la population pédiatrique dans le traitement de l'hypercalcémie induite par des tumeurs et dans la prévention des complications osseuses chez les patients atteints d'un cancer avancé avec atteinte osseuse (voir rubrique Posologie et mode d'administration pour les informations concernant l'usage pédiatrique).
Les données pharmacocinétiques suivantes, indépendantes de la dose, ont été obtenues après des perfusions uniques et répétées de 5 et 15 minutes de 2, 4, 8 et 16 mg d'acide zolédronique chez 64 patients présentant des métastases osseuses.
Distribution
Après le début de la perfusion d'acide zolédronique, la concentration plasmatique d'acide zolédronique augmente rapidement pour atteindre son pic à la fin de la perfusion et diminue ensuite rapidement à moins de 10 % du pic après 4 heures et à moins de 1 % du pic après 24 heures, avec une période prolongée ultérieure de concentration très faible ne dépassant pas 0,1 % du pic avant la seconde perfusion d'acide zolédronique le jour 28.
Élimination
L'acide zolédronique, administré par voie intraveineuse est éliminé de façon triphasique : une disparition rapide biphasique de la circulation sanguine, avec des demi-vies de t½α 0,24 et t½β 1,87 heure, suivie d'une longue phase d'élimination avec une demi-vie d'élimination terminale de t½γ 146 heures. Il n'y a pas d'accumulation plasmatique d'acide zolédronique après administration de doses répétées tous les 28 jours. L'acide zolédronique n'est pas métabolisé et est excrété sous forme inchangée par voie rénale. Pendant les 24 premières heures, 39 ± 16 % de la dose administrée sont retrouvés dans les urines, tandis que la quantité restante est principalement liée au tissu osseux. À partir du tissu osseux, il est libéré très lentement dans la circulation systémique et éliminé par voie rénale. La clairance corporelle totale est de 5,04± 2,5 l/h, est indépendante de la dose et n'est pas influencée par le sexe, l'âge, la race, ou le poids corporel. L'augmentation de la durée de perfusion de 5 à 15 minutes a entraîné une réduction de 30 % de la concentration d'acide zolédronique en fin de perfusion, mais n'a pas modifié l'aire sous la courbe de la concentration plasmatique par rapport au temps.
Comme cela est observé avec les autres bisphosphonates, la variabilité entre les patients des paramètres pharmacocinétiques de l'acide zolédronique est élevée.
Dans une étude réalisée in vitro, l'acide zolédronique a montré une affinité faible pour les composants cellulaires du sang humain, avec un rapport moyen entre la concentration sanguine et la concentration plasmatique de 0,59 dans un intervalle de concentration compris entre 30 ng/ml et 5000 ng/ml. La liaison aux protéines plasmatiques est faible, avec une fraction libre allant de 60% à 2 g/ml d'acide zolédronique à 77% à 2000 ng/ml d'acide zolédronique.
Populations particulières
Insuffisance hépatique
Aucune donnée pharmacocinétique concernant l'acide zolédronique n'est disponible chez les patients présentant une hypercalcémie ou chez les patients atteints d'insuffisance hépatique. In vitro, l'acide zolédronique n'inhibe pas les isoenzymes du cytochrome P450 humain, il ne subit pas de biotransformation et, dans les études effectuées chez l'animal, moins de 3 % de la dose administrée sont retrouvés dans les fèces, ce qui semble indiquer l'absence de rôle significatif de la fonction hépatique dans la pharmacocinétique de l'acide zolédronique.
Insuffisance rénale
Chez les 64 patients atteints d'un cancer inclus dans l'étude, la clairance rénale de l'acide zolédronique était corrélée à la clairance de la créatinine, la clairance rénale représentant 75 ± 33 % de la clairance de la créatinine, avec une moyenne de 84 ± 29 ml/min (extrêmes : 22 et 143 ml/min). L'analyse de population a montré que, chez les patients ayant une clairance de la créatinine de 20 ml/min (insuffisance rénale sévère) ou de 50 ml/min (insuffisance rénale modérée), la clairance prédictive correspondante de l'acide zolédronique devrait être respectivement de 37 % ou de 72 % de celle d'un patient ayant une clairance de la créatinine de 84 ml/min. Des données pharmacocinétiques encore limitées sont disponibles uniquement chez des patients atteints d'insuffisance rénale sévère (clairance de la créatinine < 30 ml/min).
Population pédiatrique
Les données limitées de pharmacocinétique chez l'enfant atteint d'ostéogenèse imparfaite sévère suggèrent que la pharmacocinétique de l'acide zolédronique chez les enfants et adolescents âgés de 3 à 17 ans est comparable à celle observée chez l'adulte à des doses similaires en mg/kg. L'âge, lepoids, le sexe et la clairance de la créatinine ne semblent pas avoir d'effet sur l'exposition à l'acide zolédronique.
Des effets indésirables, tels que vertiges et somnolence, peuvent avoir une influence sur l'aptitude à conduire des véhicules et à utiliser des machines. Par conséquent, les patients traités par l'acide zolédronique doivent faire preuve de prudence lors de la conduite de véhicules et de l'utilisation de machines.
Toxicité aiguë
La dose non létale la plus élevée en administration intraveineuse unique a été de 10 mg/kg de poids corporel chez la souris et de 0,6 mg/kg chez le rat.
Toxicité subchronique et chronique
L'acide zolédronique a été bien toléré lorsqu'il a été administré par voie sous-cutanée chez le rat et par voie intraveineuse chez le chien, à des doses inférieures ou égales à 0,02 mg/kg/j pendant 4 semaines. L'administration de 0,001 mg/kg/j par voie sous-cutanée chez le rat et de 0,005 mg/kg par voie intraveineuse tous les 2 à 3 jours chez le chien pendant une période allant jusqu'à 52 semaines a été également bien tolérée.
L'observation la plus fréquente dans les études à doses répétées a été une augmentation de la spongiose primaire dans les métaphyses des os longs chez les animaux en cours de croissance à presque toutes les doses, une observation qui reflète l'activité pharmacologique du médicament sur la résorption osseuse.
Les marges de sécurité relatives aux effets rénaux étaient faibles dans les études effectuées chez l'animal en administration répétée par voie parentérale à long terme, mais les doses sans effets adverses observé (DSEO) cumulées dans les études à dose unique (1,6 mg/kg) et à doses répétées d'une durée allant jusqu'à un mois (0,06-0,6 mg/kg/j) n'ont pas montré d'effets rénaux à des doses équivalentes ou excédant la dose thérapeutique la plus élevée envisagée chez l'homme.
L'administration répétée à plus long terme de doses d'acide zolédronique voisines de la dose thérapeutique la plus élevée envisagée chez l'homme, a produit des effets toxiques sur d'autres organes, notamment l'appareil digestif, le foie, la rate, les poumons, et au niveau des sites d'injection IV.
Toxicité sur la reproduction
L'acide zolédronique est tératogène chez le rat par voie sous-cutanée à des doses ≥ 0,2 mg/kg. Bien qu'aucun effet tératogène ou fœtotoxique n'ait été observé chez le lapin, une toxicité maternelle a été mise en évidence. Une dystocie a été observée chez le rat à la dose la plus faible testée (0,01 mg/kg de poids corporel).
Mutagenèse et potentiel cancérogène
L'acide zolédronique ne s'est pas révélé mutagène au cours des tests de mutagenèse, et les études de cancérogenèse n'ont pas mis en évidence de potentiel cancérogène.
Des informations supplémentaires sur la manipulation d'Acide zolédronique medac 4 mg/100 ml solution pour perfusion, incluant des instructions pour la préparation de doses réduites à l'aide du flacon de solution prête à l'emploi d'Acide zolédronique medac, sont présentées à la rubrique Posologie et mode d'administration.
La préparation doit se faire dans des conditions aseptiques. A usage unique.
Ne pas utiliser une solution présentant des particules et une coloration anormale.
Il est rappelé aux professionnels de santé que toute solution d'Acide zolédronique medac non utilisée ne doit pas être jetée au tout-à-l'égout.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
liste I
médicament nécessitant une surveillance particulière pendant le traitement
médicament nécessitant une surveillance particulière pendant le traitement
Solution pour perfusion Solution incolore limpide.
Flacon en verre de type I incolore avec bouchon en caoutchouc halobutyle recouvert de fluoropolymère et capsule flip-off en aluminium.
Chaque flacon contient 100 ml de solution.
Acide zolédronique medac est présenté en boîte contenant 1 flacon.
Un flacon de 100 ml de solution contient 4 mg d'acide zolédronique (sous forme de monohydrate). Un ml de solution contient 0,04 mg d'acide zolédronique (sous forme de monohydrate).
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Mannitol
Citrate de sodium
Eau pour préparations injectables