TANGANIL 500 mg-5 ml, solution injectable I.V. en ampoule, boîte de 5 ampoules de 5 ml
Dernière révision : 17/04/2025
Taux de TVA : 2.1%
Prix de vente : 2,31 €
Taux remboursement SS : 30%
Base remboursement SS : 2,31 €
Laboratoire exploitant : PIERRE FABRE MEDICAMENT
Ce médicament est indiqué dans le traitement symptomatique de la crise vertigineuse chez l'adulte.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Des réactions d'hypersensibilité (pouvant être sévères, par exemple choc anaphylactoïde, œdème laryngé) ont été observées. Le traitement doit être interrompu dès les premiers signes d'une réaction d'hypersensibilité après l'administration d'acétylleucine (voir rubrique Effets indésirables).
Les effets indésirables sont classés comme indiqué ci-dessous par classe de systèmes d'organes MedDRA et par fréquence. La fréquence est définie selon la convention suivante : très fréquente (≥ 1/10), fréquente (≥ 1/100 et < 1/10), peu fréquente (≥ 1/1 000 et < 1/100), rare (≥ 1 /10 000 et < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée à partir des données disponibles).
| CLASSE
DE SYSTEMES
D'ORGANES (Classification MedDRA) | Très rare (<1/10,000) | Fréquence indéterminée |
| Affections du système immunitaire | | Réactions d'hypersensibilité, choc anaphylactoïde et œdème laryngé |
| Affections de la peau et du tissu sous-cutané | Démangeaisons (parfois associées à du prurit), érythème, urticaire | |
| Troubles généraux et anomalies au site d'administration | | Réactions au site d'injection (telles que douleur, œdème ou hématome) |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
CONTACTER LE MÉDECIN en absence d'amélioration ou en cas d'aggravation des symptômes après 3 jours de traitement.
CONTACTER IMMÉDIATEMENT LE MÉDECIN en cas de :
- Réactions allergiques.
-Choc anaphylactoïde (réaction allergique sévère et soudaine avec difficultés respiratoires, gonflement, étourdissements, rythme cardiaque rapide, transpiration et perte de conscience).
-Oedème laryngé (gonflement).
CONTACTER IMMÉDIATEMENT LE MÉDECIN en cas de :
- Réactions allergiques.
-Choc anaphylactoïde (réaction allergique sévère et soudaine avec difficultés respiratoires, gonflement, étourdissements, rythme cardiaque rapide, transpiration et perte de conscience).
-Oedème laryngé (gonflement).
Grossesse
Il n'existe pas de données ou il existe des données limitées sur l'utilisation de l'acétylleucine chez la femme enceinte. Il n'existe pas de données chez l'animal en ce qui concerne la toxicité sur la reproduction (voir rubrique Données de sécurité préclinique). Par mesure de précaution, il est préférable d'éviter l'utilisation de TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule durant la grossesse.
Allaitement
On ne sait si l'acétylleucine et ses métabolites sont excrétés dans le lait maternel. Un risque pour l'enfant allaité ne peut être exclu. TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule ne doit pas être utilisé durant l'allaitement.
Fertilité
Il n'y a pas de données sur les effets de l'acétylleucine sur la fertilité.
Aucune étude d'interaction n'a été réalisée.
Posologie
2 ampoules par jour (jusqu'à 4 si nécessaire).
La durée du traitement est variable selon l'évolution clinique.
Mode d'administration
Utilisation intraveineuse directe.
Durée de conservation :
5 ans.
Après ouverture : le produit doit être utilisé immédiatement.
Précautions particulières de conservation :Pas de précautions particulières de conservation.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
Les informations concernant les surdosages avec l'acétylleucine sont limitées.
En cas de surdosage, un traitement symptomatique doit être pris si nécessaire.
Classe pharmacothérapeutique : ANTIVERTIGINEUX, Code ATC : N07CA04.
Après administration de 1 g de TANGANIL par voie intraveineuse, on observe une cinétique bicompartimentale avec une phase de distribution très rapide (demi-vie moyenne de 0,11 heure) et une phase d'élimination rapide (demi-vie moyenne de 1,08 heure).
TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
Les données non cliniques ne révèlent aucun risque significatif pour l'homme sur la base d'études conventionnelles de toxicité à doses aiguës et répétées.
Il n'existe aucune donnée de toxicité disponible pour évaluer les effets du produit sur la fertilité et le développement embryo-fœtal.
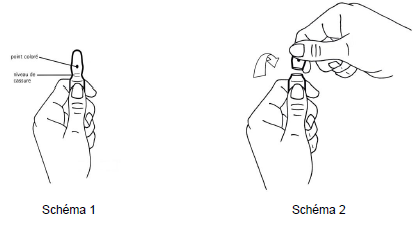
Mode d'ouverture des ampoules OPC (One point cut)
Avant d'ouvrir l'ampoule assurez-vous qu'il ne reste plus de solution dans la partie supérieure de l'ampoule.
Les ampoules sont munies d'un système d'ouverture OPC et doivent être cassées selon les instructions suivantes :
1. D'une main tenir fermement le corps de l'ampoule, point coloré face à vous (schéma 1).
2. De l'autre saisir la partie supérieure de l'ampoule (index posé derrière le col de l'ampoule et le pouce sur le point coloré comme indiqué dans le schéma 2).
3. En tenant fermement chaque partie de l'ampoule, casser d'un coup sec la partie supérieure en exerçant une pression dans la direction opposée au point coloré (schéma 2).
Médicament non soumis à prescription médicale.
Solution aqueuse claire, pratiquement incolore et sans particules visibles.
5 ml en ampoule (verre) transparente à fond plat. Boîte de 5.
Acétylleucine........................................................................................................................ 500 mg
Pour une ampoule.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Monoéthanolamine, eau pour préparations injectables.